作者简介:张东华,男,1960年生,副主任技师,主要从事免疫学、分子生物学研究。
通讯作者:张欣欣,联系电话:021-64370045-361088。
评估聚合酶链反应(PCR)-荧光探针法用于乙型肝炎病毒基因聚合酶区YMDD变异检测的敏感性、特异性和准确性。
方法采用PCR-荧光探针法和DNA序列分析法,平行比对检测202份标本中HBV YMDD变异情况。
结果以DNA序列检测分析为相对标准,PCR-荧光探针法检测YMDD变异的相对灵敏度为99.06%,相对特异性为97.92%, YMDD变异位点检测的准确性为98.51%。PCR-荧光探针法检测YMDD位点混合变异株稍优于序列分析法。
结论PCR-荧光探针法与DNA序列分析法检测HBV YMDD变异具有较好的一致性,说明对单个位点变异的检测该方法临床应用性能较好。
To evaluate the sensitivity, specificity and accuracy of polymerase chain reaction (PCR)-fluorescent-probe assay for the detection of Hepatitis B virus tyrosine-methionineaspartate-aspartate (YMDD) mutation.
Methods202 samples were detected for HBV YMDD mutation by PCR-fluorescent-probe assay and DNA sequencing analysis simultaneously.
ResultsThe results of DNA sequencing were used as standard, and the sensitivity,specificity and accuracy of PCR-fluorescent-probe assay for YMDD mutation were 99.06%, 97.92%and 98.51%. For the detection of mixing mutant, the PCR-fluorescent-probe assay was better than DNA sequencing method.
ConclusionsThe PCR-fluorescent-probe assay has good consistency with DNA sequencing analysis for HBV YMDD mutation, and it has a good clinical application value in single mutation detection.
慢性乙型肝炎病毒(HBV)感染者中约50% ~75%有活跃的病毒复制和肝脏炎症改变, 部分慢性肝炎可进展为肝硬化、肝衰竭或肝癌, 是主要的疾病死亡因素之一[1]。拉米夫定作为第一个批准的口服抗HBV药物, 其问世推动了慢性乙型肝炎治疗的进程[2], 但是随着临床广泛应用, 在部分患者遇到了耐药突变问题。
HBV每24 h可复制约1012~1013个拷贝[3], 而HBV DNA聚合酶缺乏校正机制, 其突变率为(1.4~3.2)× 10-5核苷酸替代/(位点· 年)[4]。在拉米夫定外在选择压力下, 积累rtM204I、rtM204V等耐药变异, 即YMDD变异[5]。有文献报道, 部分患者使用拉米夫定治疗超过半年以上即发生耐药, 耐药一旦发生, 抗病毒疗效将降低 [6~7]。已有的基础和临床研究证实, 某些核苷类似物, 如阿德福韦(adefovir)、恩替卡韦(entecavir)等对YMDD变异株有抑制作用, 临床治疗有效[8]。因此对使用拉米夫定治疗的乙型肝炎患者进行HBV YMDD变异的检测变得十分重要, 有助于监测肝炎病情、评价抗病毒治疗的效果及调整治疗方案。
目前检测耐药突变的方法包括DNA序列测定、等位基因特异性聚合酶链反应(PCR)、核酸杂交、限制性片段长度多态性(PCR-RFLP)、基质辅助激光解吸附电离飞行时间质谱测定法(MALDI-TOF-MS)、以及荧光探针实时PCR检测等[9]。基于灵敏性、实用性和方便性等特点, 临床上对于YMDD突变的检测多采用基于特异性探针的实时荧光PCR 检测。我们以DNA序列分析法为对照, 对PCR-荧光探针法检测乙型肝炎病毒YMDD变异进行平行评价。
202例血清样本来自瑞金医院感染科及其他科室门诊和住院患者。于2006年5月至2008年1月期间收集, 血清标本自分离后置-80 ℃保存。其中乙肝患者180例(诊断标准符合2005年“ 慢性乙型肝炎防治指南” )[10], 包括服用拉米夫定至少6个月以上者140例, 非拉米夫定治疗患者40例。另设非乙肝组22例(包括甲肝6例、戊肝6例和丙肝10例)作为特异性验证对照。
HBV YMDD变异检测采用某公司PCR荧光探针法乙型肝炎病毒YMDD变异核酸检测试剂盒(RUO, 尚未获得SFDA认可), 对被检样本抽提HBV DNA, PCR反应仪为ABI7300基因扩增仪, 实验操作和结果判定按试剂盒说明进行。同时每份标本采用自制PCR反应体系扩增乙肝病毒P基因rtM204位(YMDD)处左右500 bp的目的片段, PCR扩增阳性产物由上海生工生物工程技术服务有限公司进行序列测定。测序结果通过Vector NTI9.0软件与HBV_pADR1序列进行比对, 以此判断rtM204位点(YMDD)变异情况; 对测序反应电泳扫描图谱分析, 规定叠加峰20%以上为碱基共存状态。
根据试剂盒说明所示, PCR 扩增反应Ct值≤ 38为YMDD位点变异阳性, Ct无数值或≥ 42为阴性, Ct值在38~42之间的灰区样本建议复测(共复测17例), 复测结果Ct值< 42为阳性, 否则判为阴性(对YMDD野生型样本该试剂盒检测亦表现为阴性结果)。统计分析数据均以复测结果为准。序列分析以有测序报告者视为阳性, 反之则为阴性。
以序列测定结果为相对标准, 对PCR-荧光探针法检测HBV rtM204位变异的阴阳性结果, 采用四格表方式对其临床灵敏度、特异性进行统计分析。
在202例被检标本中, PCR-荧光探针法检测到YMDD变异阳性共107例, 其中97例样本经PCR扩增判断为YIDD或/和YVDD变异阳性, 17例样本PCR反应后Ct值介于38~42灰区之间, 经复测后重新判定结果, 3例为YIDD变异, 6例为YVDD变异, 1例为YIDD+YVDD混合阳性, 其余7例为阴性。剩余66例乙肝患者样本和22例非乙肝组样本PCR扩增均为阴性, 提示无YMDD变异。依照试剂盒结果判定说明, YMDD变异阴性共95例。
相同标本采用自配PCR体系扩增HBV DNA, 扩增阳性者经序列分析得到148份测序报告, 其中106份样本显示为rtM204I(YIDD)或/和V(YVDD)变异, 42份乙肝患者样本为YMDD野生型, 属YMDD变异阴性。其余32例乙肝患者和22例非乙肝组样本因未出现HBV DNA扩增而无测序报告, 在统计时归于YMDD变异阴性, 共计96例。
以序列分析结果为相对标准, PCR检测HBV rtM204位点变异的相对灵敏度为99.06%, 相对特异性为97.92%, 阴阳性符合率为98.51%, 见表1。
| 表1 2种分析方法检测rtM204变异结果 |
17份灰区结果的样本HBV DNA水平均处于3log10~4log10数量级范围内, 复测后58.8%(10/17)的样本判定为YMDD变异阳性, 据此推测该PCR法检测HBV YMDD变异的临床灵敏度为5.0× 103拷贝/mL的DNA水平。
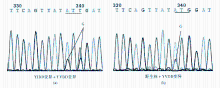
采用PCR-荧光探针法检测到12例YIDD+YVDD混合变异, 对106份序列分析阳性的电泳扫描图谱进行分析, 有15例样本在rtM204位显示混合叠加峰型, 其中11例为rt (ATG) M204I(ATT)/V(GTT/G), 4例为rt (ATG) M204M/V(GTG), 见图1。
我们的结果显示, PCR-荧光探针法与DNA序列分析法检测HBV YMDD变异具有较好的一致性, 其灵敏度、特异性和准确性评估结果, 提示该方法临床应用性能良好。
目前, 核酸测序的方法是确定DNA(RNA)变异的金标准, 不仅可以测到单个核苷酸的变异, 而且可以同时测到多个核酸变异情况。经美国疾病预防控制中心(FDA)或欧盟CE-IVD认可的临床应用自动化测序仪器及试剂系统主要有Simens公司的Open Gene测序仪及其Trugene HIV Genotyping等系列测序试剂盒, 以及美国PE ABI公司3700和3100型等DNA测序仪及其Viroseq HIV Genotyping等系列测序试剂盒。该类仪器采用毛细管电泳技术, 以凝胶电泳图谱、荧光吸收峰图或碱基排列顺序等多种形式输出测序结果, 其实验周期长, 操作复杂, 对操作要求较高, 当有几种混合变异时往往只报告出一种变异序列, 必须再对照电泳图谱作进一步分析才有可能发现混合叠加峰存在, 人力成本花费较大, 适用于研究型结果分析。
PCR-荧光探针法试剂盒可进行YIDD及YVDD变异的鉴别检测, 该试剂盒采用Taqman-MGB探针法, 与普通Taqman水解探针相比, MGB有以下优点:可以使探针的长度缩短, 尤其对AT含量高的序列的MGB探针的设计有很大的帮助, 可提高配对与非配对模板间的Tm值差异; 由于在探针的3'端的Quencher基团为不发光的荧光基团, 并且与Report基团在空间的位置更接近, 使杂交的稳定性大大提高[11]。
经拉米夫定治疗的慢性乙肝患者体内可能存在多种病毒株, 包括野生型、YIDD变异及YVDD变异的不同组合情况[12]。本研究的序列检测若单纯以序列结果比对判断rtM204位变异情况, 仅91份样本显示rtM204位变异; 进一步结合测序电泳图谱分析所发现的碱基双峰, 其峰值面积相差约为3~6倍(高度差约1.8~2.4倍), 与文献报道的测序分析分辨灵敏度20%相近[13], 提示检测分析结果可靠。且PCR试剂使用的实时荧光检测采用特异MGB探针, 对检测混合变异还稍优于序列分析, 说明该PCR-荧光探针法对单个位点变异的检测临床应用性能较好。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|