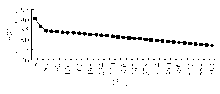作者简介:王 蓉,女,1968,学士,副主任技师,主要从事细菌、免疫学检验工作。
建立血管紧张肽(素)转化酶(ACE)自动化分析方法。
方法ACE能催化底物呋喃酰基-L-苯丙氨酰甘氨酰甘氨酸(FAPGG),产生呋喃酰基苯丙氨酸(FAP)及双甘氨肽(GG)。在pH值8.2的硼酸缓冲液下,在340 nm处测定产物吸光度值的下降速度可计算出ACE活性。采用本法测定50名正常对照者、30例慢性阻塞性肺部疾病加重期(AECOPD)患者、18例肺癌患者血清ACE的活性。
结果本法缓冲液最适pH值为8.2,最适基质浓度为1.0 mmol/L,批内、批间平均变异系数( CV)分别为4.07%、5.50%,米氏常数(Km)为0.09 mmol/L。正常对照组ACE活性为(31.1±18.0)U/L;AECOPD患者ACE活性为(22.4±12.6)U/L, 低于正常组( P<0.000 1);肺癌患者ACE活性为(28.7±11.4) U/L,稍低于正常对照组,但差异无统计学意义( P>0.05)。
结论该法简便、快捷、精确,可用于自动化分析,适宜临床常规应用。ACE可作为评价肺部疾病的一项指标。
To establish a kinetic monitoring assay for detecting angiotensin converting enzyme(ACE).
MethodsN-(3[2-Furyl]Acryloyl)-L-Phe-Gly-Gly(FAPGG) was used as substrate. ACE could catalyze the substrate to produce N-(3[2-Furyl]Acryloyl)-L-Phe (FAP) and glycine-glycine (GG) in boric acid-sodium hydroxide buffer(pH: 8.2).The activity of ACE could be calculated through determining the decreasing speed of the product at 340 nm. The ACE activities in 50 healthy controls, 30 patients with acute exacerbation chronic obstructive pulmonary disease (AECOPD) and 18 patients with lung cancer were determined by this method.
ResultsThe optimum pH value of the buffer was 8.2, and the optimum substrate concentration was 1.0 mmol/L. The within-run coefficient of variation ( CV) was 4.07%, and between-run CV was 5.50%. Michaelis constant (Km) was 0.09 mmol/L. The ACE activities were (31.1±18.0)U/L in healthy controls and (22.4±12.6)U/L in patients with AECOPD. There was a significant difference between AECOPD patients and healthy controls( P<0.000 1). The ACE activity in patients with lung cancer was (28.7±11.4) U/L. It was slightly lower than that in the healthy controls, and there was no statistical significance between patients with lung cancer and healthy subjects( P>0.05).
ConclusionsThe method is simple, rapid, accurate and suitable for automatic analysis of ACE. The method can be used for clinical application, and ACE can be an indicator for the evaluation of lung disease.
血管紧张肽(素)转化酶(angiotensin converting enzyme, ACE)的分类名为肽基二肽水解酶, 1954年Skeggs等首先发现ACE在肺中含量丰富, 是肺中唯一对循环中血管紧张素Ⅰ (AⅠ )起作用的酶。自从1975年Lieberman首次报道了肺结节病患者血清ACE活性升高, ACE的测定在临床上引起了极大的兴趣, 主要表现在肺癌、呼吸系统、各型肝炎、甲状腺功能亢进或减退病患者。
目前测定血清ACE的方法有放射性核素法、比色法、分光光度法、荧光法、毛细管胶束电动色谱法。放射性核素法易受放射性核素的污染, 不适于医院常规应用。比色法、分光光度法操作繁琐, 无法用于临床日常测定。荧光法、毛细管胶束电动色谱法[1]由于受到设备限制, 无法广泛应用。用高效液相色谱法测定组织ACE酶活性, 敏感性和特异性大大高于常用的紫外分光光度法[2]。但是由于受设备限制, 推广难度较大。我们参照Ronca-Testoni报道的用直接分光光度法测定血清ACE的方法[3], 应用上海交通大学医学院化学教研室合成的呋喃酰基-L-苯丙氨酰甘氨酰甘氨酸底物[N-(3[2-Furyl]Acryloyl)-Phe-Gly-Gly, FAPGG], 建立了ACE的动力学测定方法, 并初步应用于临床。
正常对照组为上海第二人民医院健康体检者共50名, 年龄18~68岁, 男28名, 女22名; 临床确诊为慢性阻塞性肺部疾病急性加重期(AECOPD)患者30例, 肺癌患者18例, 年龄45~90岁。
1. 仪器
雅培C8000全自动生化分析仪
2. 试剂
(1)80 mmol/L硼酸缓冲液:2.475 g硼酸+8.75 g NaCL+900 mL蒸馏水混匀, 用1 mol/L NaOH调节pH值至8.2, 用蒸馏水加至1 L, 最终缓冲液含有300 mmol/L NaCL, 80 mmol/L硼酸, pH值为8.2; (2)1.0 mmol/L FAPGG底物溶液:称取FAPGG(相对分子质量399.4)39.9 mg, 溶于100 mL硼酸缓冲液(pH值8.2)中, 避光4 ℃保存。
3. ACE测定原理
ACE催化底物FAPGG水解生成呋喃酰基苯丙氨酸(FAP)及双甘氨肽(GG), 从而引起340 nm处吸光度(A)值的下降, 通过测定FAPGG在340 nm处A值下降的速度可计算出ACE的活性。以37 ℃时, 每升血清每分钟释放1 μ mol双甘肽所需酶量为一个活性单位[U/L=μ mol/(L· min)]。
4. ACE测定方法
(1)参数:波长340 nm, 温度37 ℃, 血清20 μ L, 试剂180 μ L, 延迟时间60 s, 测定时间120 s, 测定方式为连续监测法, K值为6 666.6; (2)计算:ACE(U/L)=Δ A/min× 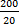
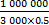
应用SPSS13.0统计软件。测定结果用 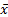
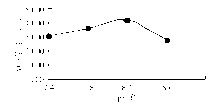
1. 酶促反应最适pH值
基质浓度固定为1.0 mmol/L, 配制pH值7.4~8.6的缓冲液。同时与1份样本作用, 结果pH值8.2时酶活性最高。见图1。
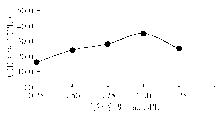
2. 最适底物浓度
在pH值8.2条件下, 分别用0.25~1.25 mmol/L的底物浓度测定1份样本, 反应曲线显示, 最适底物浓度为1.0 mmol/L。见图2。
3. 缓冲液选择
使用50 mmoL/L三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲液及50 mmoL/L 4-羟乙基哌嗪乙磺酸酸(HEPES)缓冲液测定ACE, ACE活性较低; 而80mmoL/L硼酸缓冲液较合适。见表1。
| 表1 3种缓冲液测定酶活力的比较 |
4. 米氏常数(Km)测定
不同浓度的底物对反应的影响由1/[V]对1/[S]绘制Linenear-Buk图。从图中得出1/Km=11。ACE对底物的Km为0.09 mmol/L。见图3。
5. 酶促反应连续监测时间确定
取酶活性为61.35 U/L的样本进行测定, 每18 s读取1次A值直至9.9 min。发现3.6~9.9 min时, A值呈线性, 故定延迟时间为3.9 min, 测定时间为2.7 min。数据经统计学处理, r=0.999 6。见图4。
取1管酶活性为82.5 U/L的血清, 用缓冲液按1/5~5/5比例稀释测定, 结果显示A值变量与稀释度呈线性。见图5。
取1份新鲜血清分30份放入-20 ℃低温冰箱中, 每天取1份测定其活性, 发现30 d内酶活性无明显变化。
在测试系统中分别加入2 mg/100 mL的谷胱甘肽和1, 4二硫代苏糖醇作为稳定剂, 合并一对照管(无稳定剂)置4 ℃冰箱4周, 取出后检测同一血清样本。结果发现谷胱甘肽和1, 4-二硫代苏糖醇对底物缓冲液均有作用。1, 4-二硫代苏糖醇作为稳定剂效果更好。
| 表5 稳定剂的选择 |
取新鲜配置好的试剂, 内含2 mg/100 mL 1, 2二硫代苏糖醇作为稳定剂, 测定其A值, 然后放置4 ℃冰箱避光保存, 每天测定该试剂A值, 连续测定4周。4周内试剂稳定性良好。
AECOPD组血清ACE活性明显低于正常对照组(P< 0.000 1)。肺癌组ACE活性稍低于正常组, 但差异无统计学意义(P> 0.05), 见表6。
表6 AECOPD组、肺癌组及正常对照组血清ACE活性比较(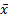 ± s, U/L) ± s, U/L) |
ACE能作用于肽键, 催化肽基二肽水解, 在体内主要催化血管紧张素Ⅰ 肽链C-末端的组氨酸和亮氨酸残基水解, 形成具有升压作用的血管紧张素Ⅱ , 后者具有使血管收缩、血压升高等的作用。因此ACE是肾素-血管紧张素-醛固酮及缓激肽系统的重要调节因素。
1979年, Holmquist等[4]首次提出了用FAPGG作为底物, 在ACE的水解作用下, 其反应产物在328~354 nm波长范围内发生A值下降变化。2006年, Shalaby等采用微量反应体系(50 mmol/L Tris-HCl缓冲液, pH值7.5), 使用0.88 mmol/L FAPGG为底物, 用速率法来测定ACE酶抑制剂活性以及用HHL为底物, 用高效液相色谱法测定ACE酶抑制剂活性作了探讨, 认为每种方法都有其局限性, 但是前者操作步骤更简易, 样本用量少, 对于仪器的要求也不高[5]。
Ronca-Testoni[3]报道的用FAPGG作为底物, 采用直接分光光度法测量血清ACE活性, 反应时间较长, 整个反应需20 min。本研究建立的连续监测法整个监测反应仅需8 min。本法最适pH值为8.2, 最适基质浓度为1.0 mmol/L, 批内、批间平均CV分别为4.07%、5.5%, Km为0.09 mmol/L。正常对照组血清ACE活性为(31.1± 18.0)U/L, 肺癌组ACE活性为(28.7± 11.4) U/L, 2组间差异无统计学意义(P> 0.05), 和部分学者用紫外比色法[6、7]报道的检测值相近。但与Ronca-Testoni[3]报道的正常人血清ACE值(检测均值为90.2 U/L)差异较大。这可能和底物的合成、反应的条件等因素有关。AECOPD患者ACE活性为(22.4± 12.6) U/L, 明显低于正常对照组(P< 0.000 1)。该法简便、迅速, 精确, 适用于全自动生化分析仪的动力学检测, 适于各级医院常规应用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|