作者简介:王克迪,女,1985年生,主要从事分子生物学研究。
通讯作者:康熙雄,联系电话:010-67096881。
探讨健康人群趋化因子CXC配体16(CXCL16)基因多态性与血清CXCL16、C反应蛋白(CRP)水平的相关性。
方法采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)方法检测204名健康体检者CXCL16基因A181V多态性,同时分别应用酶联免疫吸附试验(ELISA)和免疫比浊法检测血清CXCL16和高敏CRP(hs-CRP)水平,并进行统计学分析。
结果AA基因型血清hs-CRP水平明显高于GG、GA基因型( P=0.01);多元线性回归显示A等位基因是高hs-CRP水平的独立危险因素( OR=1.25,95% CI:1.08~2.59, P=0.021);以血清hs-CRP水平中位数(0.91 mg/L)为界定值分为2组,AA基因型和A等位基因频率在hs-CRP>0.91 mg/L组中显著升高( P=0.008,0.036);而血清CXCL16水平与其基因型间差异无统计学意义( P>0.05)。
结论CXCL16基因A181V位点基因多态性与血清hs-CRP水平相关,A等位基因可能参与机体炎症反应的发生、发展。
To investigate the association of serum chemokine CXC ligand 16 (CXCL16)and C reactive protein (CRP) levels with CXCL16 gene polymorphism in healthy subjects.
MethodsThe polymorphisms of CXCL16 gene A181V were detected in 204 healthy subjects by polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP). Enzyme-linked immunosorbent assay (ELISA) and particle-enhanced immunonephelometry were used to detect serum CXCL16 and high sensitive CRP(hs-CRP) levels respectively, and the results were analyzed statistically.
ResultsSerum hs-CRP levels in AA genotype were significantly higher than those in GG and GA genotypes( P=0.01). Multiple linear regression showed that A allele was an independent risk factor of high-level hs-CRP( OR=1.25,95% CI:1.08-2.59, P=0.021). 2 groups were set according to the median of hs-CRP levels(0.91 mg/L). AA genotype and A allele frequencies were significantly higher in group with higher hs-CRP level than those in group with lower one( P=0.008,0.036). However, there was no significant difference between serum CXCL16 levels and its genotypes( P>0.05).
ConclusionsCXCL16 gene A181V polymorphism is associated to serum hs-CRP levels, and A allele may be involved in the occurrence and development of inflammatory response.
C反应蛋白(CRP)是炎症、感染和组织损伤急性期反应的非特异性标志物, 是反映机体炎症状态的一种敏感、可靠的指标, 其基础水平与很多因素相关, 如性别、年龄、体重指数、血脂、血压、环境因素、生活方式、遗传因素等, 在各种因素所导致的个体CRP水平差异中, 遗传因素所起的作用能够达到40%[1]。因此研究遗传因素对于CRP水平的影响尤为重要。趋化因子CXC配体16(chemokine CXC ligand 16, CXCL16)[2~4]作为趋化因子, 在炎症-免疫反应中起着重要作用, 其参与了调控炎症细胞的募集、活化及细胞因子的表达, 而CRP的表达水平与相关细胞因子刺激密切相关。因此, 我们考虑CXCL16的氨基酸A181V多态性可能通过影响血清CXCL16的表达, 进而调节CRP的水平。
选择2008年9月到2009年4月北京天坛医院的健康体检者204名, 其中男122名、女82名, 年龄40~80岁。
1. 标本采集
(1)取入组者晨起空腹静脉血2~3 mL, 乙二胺四乙酸二钾(EDTA-K2)抗凝, -80 ℃保存备用; (2) 取入组者晨起空腹静脉血2~3 mL, 离心分离血清, 采用生物化学法测定血糖、血脂和肝肾功能。
2. 血清高敏CRP(hs-CRP)测定
采用HITACHI(日立)7600全自动生化分析仪检测血清hs-CRP水平。
3. 血清CXCL16测定
采用美国R& D公司生产的CXCL16定量测定试剂盒, 操作严格按试剂盒说明书进行。
4. 引物设计
采用计算机国际互联网在人类基因库中对CXCL16的SNPs进行检索, 选定A181V, 根据引物设计原则, 设计上游引物:5'-ATG CTC CTG TCC ACC TTG C-3'; 下游引物:5'-CCA GAG TCA ACC TTG TGC AG-3', 由上海英骏生物有限公司合成。
5. 人外周血白细胞基因组DNA的提取
应用Blood DNA kit试剂盒, 由Omega公司提供。
6. 基因型检测
用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)方法进行基因型检测。(1)PCR反应总体系25 μ L:10× PCR buffer 2.5 μ L(包括Tris-HCl 20 mmol/L, KCl 50 mmol/L, MgCl2 1.5 mmol/L), dATP、dCTP、dGTP和dTTP 2.0 μ L(各2.5 mmol/L), Taq酶 1 U, 上游、下游引物各1.0 μ L(5 pmol/μ L), 模板2.5 μ L, 加灭菌水至25 μ L; (2)PCR循环条件:94℃预变性5 min, 94℃变性30 s, 54℃退火30 s, 72℃延伸30 s, 72℃充分延伸7 min, 32个循环; (3)PCR产物经2.5%琼脂糖凝胶电泳、Goldview染色, 紫外灯下检测扩增结果, 以备下一步试验; (4)酶切体系20 μ L:PCR产物10 μ L, 10× NE Buffer 2 μ L、PvuⅡ 1 μ L、灭菌水 7 μ L, 此混合物在37℃水浴中消化2 h。经3%琼脂糖凝胶电泳、Goldview染色, 紫外灯下观察, 并记录结果。
采用SPSS13.0软件进行数据分析:计量资料中服从正态分布者以 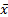
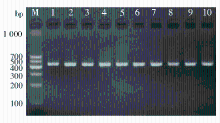
A181V为G/A型SNP, 在群体中组成GG、GA及AA 3种不同基因型。基因组DNA经PCR扩增出439 bp片段, 如图1所示。当A181V为G等位基因时, 存在PvuⅡ 限制性内切酶酶切位点, 酶切后产生315和124 bp 2个片段。因此, 当被检个体为GG基因型时, 电泳可见到315和124 bp 2条片段; 当被检个体为GA基因型时, 电泳时可见到439、315和124 bp 3条片段; 当被检个体为AA基因型时, 电泳只看见439 bp 1条片段。见图2。
对研究对象的SNP基因型进行了平衡检验, 结果表明其基因型频率分布没有偏离Hardy-Weinberg平衡(χ 2=0.055 0, P=0.814 6)。
GG、GA和AA型3种基因型间年龄、性别、空腹血糖、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血清CXCL16水平及吸烟史、饮酒史相比较, 差异无统计学意义(P均> 0.05); AA型血清hs-CRP水平明显高于GG、GA型(P=0.01)。见表1。
| 表1 3种基因型临床资料、生化指标、血清CXCL16和hs-CRP水平 |
血清hs-CRP浓度取自然对数后服从正态分布, 以ln(血清hs-CRP浓度)作为因变量, 年龄、性别、空腹血糖、TG、TC、LDL-C、HDL-C及吸烟史、饮酒史、CXCL16基因A181V多态性作为自变量, 进行多元线性回归分析。结果显示, CXCL16基因A181V多态性与血清hs-CRP水平独立相关(OR=1.25, 95%CI:1.08~2.59, P=0.021)。
以血清hs-CRP水平中位数(0.91 mg/L)作为界定值分成2组, 比较不同基因型和等位基因频率。结果显示, AA基因型及A等位基因频率在hs-CRP> 0.91 mg/L组中所占比例明显高于≤ 0.91 mg/L组。等位基因频率的相对风险分析发现, A等位基因携带者有高hs-CRP水平的风险是G等位基因的2.275倍(OR=2.275, 95%CI:1.039~4.981)。见表2。
| 表2 2组间基因型和等位基因频率分布[例(%)] |
CRP是一种经典的急性期蛋白, 其基因表达的调控主要发生在转录水平, 依赖于白细胞介素-6(IL-6)激活转录因子信号转导子与转录激活子3(STAT3)、CCAAT/增强子结合蛋白(C/EBP)家族成员和核转录因子-κ B(NF-κ B)而实现[5], 同时糖皮质激素和某些其他因素包括补体活化产物也可与IL-6协同作用, 加强其效应[6]。正常情况下CRP以微量形式存在于健康人的血清中, 当受到前炎症因子, 如白细胞介素-1(IL-1)、IL-6等作用时, 其水平可上升100~1 000倍。近年多项研究表明hs-CRP水平与冠心病的发生过程直接相关。健康人群中hs-CRP水平轻度升高将会显著增加心血管疾病的发病风险, 其能独立预测近期和远期心脏事件的发生[7, 8]。
CXCL16有分泌型和膜结合型2种存在形式。在炎症反应中, 分泌型CXCL16发挥趋化因子作用, 将炎症细胞募集到靶位点, 激活单核-巨噬细胞产生大量细胞因子如肿瘤坏死因子α (TNF-α )、IL-1、IL-6等。细胞因子又强有力地刺激平滑肌细胞增殖和诱导肝细胞产生大量急性反应蛋白, 导致炎症反应发生。而膜结合型CXCL16发挥类似黏附分子作用, 将募集到的炎症细胞固定在炎症反应部位。氨基酸A181V多态性位于CXCL16跨膜结构区域, 而肿瘤坏死因子α 转化酶(TACE)、人解整合素样金属蛋白酶10(ADAM10)等脱落酶的作用位点恰位于该区域。因此, 考虑这种氨基酸序列的改变可能影响CXCL16由膜结合型向分泌型转化, 进而影响相关炎症因子及急性反应蛋白的表达。
本研究结果显示, 氨基酸A181V多态性与血清CXCL16水平无相关性, 而与血清hs-CRP水平密切相关, AA型血清hs-CRP水平明显高于GG型、GA型。在hs-CRP> 0.91 mg/L组中, AA基因型和A等位基因分布频率显著升高, 多元线性回归分析显示A等位基因是血清hs-CRP水平升高的独立危险因素。目前, 关于CXCL16基因多态性与hs-CRP相关性报道甚少。Lundberg等[9]通过对387例急性冠状动脉综合征患者研究发现, A等位基因与冠状动脉狭窄程度呈正相关。Seiderer等[10]通过对炎症性肠病患者该位点的研究发现, 其与疾病的易感性无相关性, 但A等位基因携带者发病年龄较小, 且回肠更容易受累。上述研究均表明A181V多态性参与炎症反应的发生、发展, A等位基因可能是一种炎症反应的独立危险因素, 但其作用机制尚有待于进一步研究。本研究未发现A181V多态性与CXCL16血清水平的相关性, 一方面考虑血清CXCL16浓度受多方面因素影响, 可能存在一些未知的因素干扰; 另一方面, 该多态性位点可能不影响分泌型CXCL16, 而是通过调节膜结合型CXCL16表达, 进而影响细胞因子的表达, 使血清CRP水平发生变化。因此, 进一步扩大试验例数、同时检测膜结合型CXCL16表达水平是有必要的。
炎症反应本身呈现一种瀑布效应, 早期炎症因子发生微小变化就会引起结果的逐层扩大。CXCL16参与早期炎症反应, 且A181V多态性与血清CRP水平密切相关。因此, 该多态性位点可能比CRP更早反映机体的炎症状态, 将有可能成为预测心血管疾病新分子, 为基因水平的诊断和开发研制药物提供了新方向。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|