作者简介:吴蓓颖,女,1983年生,硕士,技师,主要从事分子遗传学及肿瘤分子生物学研究。
在最新的研究中, 肿瘤蛋白53(TP53)诱导的糖酵解和凋亡的调控子(TP53-induced glycolysis and apoptosis regulator, TIGAR)被描述为一个新的可被P53诱导的调节糖酵解的蛋白[1]。TIGAR是组氨酸酶超家族的成员, 以组氨酸为核心, 在后续的反应过程中被磷酸化, 显示了在调节糖酵解、细胞内活性氧类(reactive oxyen species, ROS)水平和凋亡方面与6-磷酸果糖激酶-2及果糖-2, 6-二磷酸酶相似的功能[2~4]。在细胞中TIGAR的高表达会降低2, 6-二磷酸果糖水平, 抑制糖酵解的限速酶6-磷酸果糖激酶-1, 抑制糖酵解。虽然肿瘤细胞的糖酵解降低了, 但TIGAR的高表达却使磷酸戊糖途径作用增强, 引起还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)增高, 抑制ROS引起的细胞凋亡, 有利于肿瘤细胞的生长[5]。我们建立了TIGAR定量酶联免疫吸附试验(ELISA), 并测定肿瘤患者及对照者血清中TIGAR含量, 探讨TIGAR检测用于临床标本的可能性。
1. 研究对象 40例肿瘤患者(肺癌13例、结肠癌13例、胃癌4例、胰腺癌3例、直肠癌6例及乳腺癌患者1例, 均经瑞金医院病理科诊断证实), 其中男20例, 女20例。另取40名健康人作为对照(性别、年龄分布与肿瘤患者组相同)。研究对象的血清标本来自瑞金医院检验科血清库。
2. 试剂 弗氏完全佐剂、生物素酯(Biotin-XX-NHS)(美国Sigma公司), Ni-NTA spin column试剂盒(德国Qiagen公司), 兔抗组氨酸(His-5)抗体(美国Santa Cruz公司), 电化学发光(ECL)试剂盒(碧云天生物技术公司), 链霉亲和素-辣根过氧化物酶(SA-HRP)(BD公司), 四甲基联苯胺(TMB)/H2O2(德国欧蒙公司), BCA试剂盒(碧云天生物技术公司)。
3. 主要仪器 台式低温离心机(Heraeus公司), 水平电泳仪、聚丙烯酰胺凝胶电泳(PAGE)和电转移装置(上海天能公司), 酶标仪(KHB), 96孔酶标板(美国Corning公司)。
4. 重组质粒序列分析 上海Invitrogen生物技术有限公司。
5. 实验动物 3月龄雄性新西兰大耳兔, 动物实验在上海交通大学医学院实验动物科学部完成[许可证编号 SYXK(沪)2003-0026]。
1. 原核表达载体的构建 根据GenBank中提供的TIGAR序列(NM-020375), 分别设计上游引物:5'- CGCCATATGGCTCGCTTCGCTCTGACTGTT-3', 引入酶切位点Nde I; 下游引物:5'- CGACT-CGAGGCGAGTTTCAGTCAGTCCATT -3', 引入酶切位点Xho I。以本实验室保留菌株DH5α pEGFP-TIGAR质粒作为模板, 聚合酶链反应(PCR)参数:94 ℃预变性5 min, 94 ℃变性40 s、58 ℃退火40 s、72 ℃延伸90 s, 共35个循环, 70 ℃延伸5 min。利用Nde I和Xho I对PCR产物和原核表达载体pET-28a(+)分别进行双酶水解, 纯化后将两者按2∶ 1混合, 用T4 DNA连接酶于16 ℃连接过夜。连接产物转化DH5α 菌后挑取单个菌落, 经PCR扩增、限制性内切酶水解反应和序列分析等方法验证。
2. TIGAR融合蛋白抗原的制备和纯化 重组质粒pET28-TIGAR转化到BL21(DE3)plysS菌, 37 ℃培养过夜。取单个菌落经PCR鉴定及酶切鉴定后, 接种到5 mL LB培养基(含卡那霉素30 mg/L)。37 ℃振荡过夜, 按1∶ 100的比例接种到200 mL LB培养基中, 37 ℃培养2 h至吸光度(A)600=0.4~0.6时, 加入异丙基-β -D硫代半乳糖苷(IPTG)至终浓度为0.5 mmol/L, 继续诱导5 h。用Ni-NTA方法纯化目的蛋白, 用含有不同浓度咪唑的缓冲液(GuNTA-10、GuNTA-20、GuNTA-60、GuNTA-200、GuNTA-500)洗脱, 获得目的蛋白后, 用生理盐水透析, 并用聚乙二醇(PEG) 8000浓缩蛋白, 用BCA试剂盒测定蛋白浓度。
3. 抗血清的制备和纯化 (1)将纯化后的抗原与弗氏完全佐剂等体积混合, 按800 μ g/只的抗原剂量分别免疫2只新西兰大耳兔, 背部皮下多点注射, 在14、28及35 d时各加强免疫1次, 剂量减半。45 d时颈动脉放血, 离心后分离血清; (2)高速离心除去抗血清中细胞残渣及小颗粒物质, 向上清液中加入饱和硫酸铵, 使终浓度为1∶ 1(V∶ V), 在4 ℃条件下搅拌6 h, 使沉淀充分, 14 000 r/min(离心半径为4.55 cm)离心20 min, 弃去上清。采用少量生理盐水复溶沉淀, 并透析24 h去除硫酸铵, 最后用BCA试剂盒测定上清液中蛋白含量。
4. 抗血清的包被 将包被用的纯化抗血清用磷酸盐缓冲液(PBS)稀释, 配置成终浓度为5、10、20、40 μ g/mL的包被液, 在96孔反应板中加入100 μ L/孔, 于4 ℃条件下静置18 h。以空白对照A值最低且不同浓度标准品测定A值具有较好线性的抗体浓度作为最佳的抗体包被浓度。
5. 抗体的生物素标记 用0.1 mol/L的NaHCO3将抗血清稀释至2 mg/mL, 按每毫升抗血清加入20 μ L生物素酯的比例混合, 混匀后置室温3 h, 期间颠倒混匀数次, 再用pH值7.2的PBS充分透析, 去除未连接的生物素酯。
6. ELISA测定TIGAR方法的建立 向包被好抗血清的酶标板孔中加入100 μ L标准品或待测血清, 在37 ℃的条件下反应2 h。用PBS洗涤3次, 再加入终浓度为1 μ g/mL的标记了生物素的抗TIGAR抗体100 μ L, 在37 ℃的条件下反应30 min。洗涤3次后加入1∶ 1 000稀释的SA-HRP 100 μ L, 在37 ℃条件下反应30 min。洗涤3次, 加入TMB/H2O2底物100 μ L, 在室温中放置10~15 min后用硫酸终止反应, 在波长450 nm处测定A值, 绘制标准曲线, 并计算血清标本中TIGAR的含量。
用curveExpert 1.3软件绘制标准曲线, 采用SAS 8.0统计软件进行数据分析, 对肿瘤组和对照组测定结果分别进行正态性检验及秩和检验。
原核表达质粒测序结果与GenBank公布的序列比较, 核苷酸和氨基酸序列的一致性为100%。
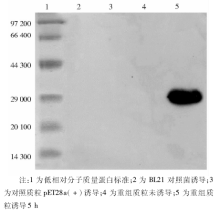
经十二烷基硫酸钠(SDS)-PAGE鉴定, 重组pET28-TIGAR在IPTG浓度为0.5 mmol/L的条件下诱导5 h的表达量最大; 用Ni-NTA试剂盒纯化带有His标签的目的蛋白, GuNTA-200洗脱液可使蛋白洗脱率最高。用Western blot检测目的蛋白, 在30 000处诱导菌有较强的条带, 提示经IPTG诱导后获得了带有His标签的融合蛋白, 而BL21对照菌、带有pET28a(+)的BL21及未经诱导的重组质粒在鉴定时, 均未发现此条带, 见图1。目的蛋白溶液经PEG8000浓缩, 用BCA试剂盒测定蛋白含量, 浓度为2.01 ng/mL。此溶液作为抗原, 应用时以生理盐水稀释。
1. 抗血清的效价 经ELISA检测抗血清效价> 1∶ 50 000。
2. 抗血清的蛋白浓度 经硫酸铵纯化的抗血清浓度为70 mg/mL。
3. 抗血清包被浓度的确定 用不同稀释度的纯化抗血清进行包被, 以10 μ g/mL最佳。
1. 标准曲线的制备 用浓度为0.1、0.2、0.4、0.8、1.0 μ g/mL的TIGAR蛋白作为标准品, 作复孔检测, 将得到的A值取平均数后, 得到拟合曲线方程为Y=(1.068X-0.035)/(0.005X2+0.494X+1), 相关系数(r)=0.99。本检测方法最低检测下限为0.1 μ g/mL, 线性范围为0.10~1.00 μ g/mL, 标准曲线见图2。
2. 临床标本的测定 用建立的ELISA对40例肿瘤患者和40名对照者血清标本进行测定。分别对2组数据进行正态性检验, P均< 0.01, 提示此2组数据为非正态分布, 故对其检测结果的统计以中位数(范围)表示。肿瘤组TIGAR水平为0.24 μ g/mL(0.12~0.53 μ g/mL), 对照组为0.16 μ g/mL(0.10~0.22 μ g/mL), 二者差异有统计学意义(S=954.5, P< 0.01)。对照组95%可信区间为0.10~0.20 μ g/mL, 肿瘤组95%可信区间为0.12~0.52 μ g/mL, 有75%标本测得值高于对照组测得的参考范围上限(0.20 μ g/mL)。
肿瘤的发生、发展和多种因素有关, 近年来的研究表明P53肿瘤抑制因子在对细胞压力的应答和细胞恶性转化发展的抑制方面有重要作用[6]。P53的功能丢失导致大多数肿瘤的发生, 他被认为与诱导细胞凋亡、细胞周期阻滞、衰老以及分化有关[7]。同时, P53在修复DNA损伤时也具有重要的作用, 并且他有诱导可逆转细胞周期阻滞的能力, 可以使细胞在重返正常增殖周期前从损伤中恢复[8]。在最新的研究中, TIGAR被描述为一个新的可被P53诱导的、调节糖酵解和抗氧化作用的蛋白[1]。在细胞恶性转变的过程中, P53在细胞压力的环境中表达增高而激活TIGAR, 使后者表达增高, 导致细胞内2, 6-二磷酸果糖水平降低, 糖酵解受到抑制, 即便如此肿瘤细胞仍可由P53诱导的细胞色素C氧化酶2合成, 由线粒体为其提供代谢所需的能量[5]。然而TIGAR的激活使戊糖旁路途径增强, 细胞内NADPH含量增高, 后者作为谷胱甘肽还原酶的辅酶, 使胞内谷胱甘肽的水平增高, 启动活性氧的清除, 降低了ROS表达, 从而减少细胞的死亡或降低细胞凋亡, 使细胞向过度增殖的方向发展。由于TIGAR作为P53依赖的生存信号, 可能是细胞DNA获得修复机会过程中所必须的, 因此TIGAR成为近来的关注点[1]。
TIGAR表达量的高低与肿瘤的生长有关, 但目前对TIGAR的研究主要集中于分子生物学与细胞生物学水平, 国内外尚无直接检测患者血清中TIGAR含量的报道。我们制备了TIGAR抗原和抗血清, 建立了ELISA双抗夹心法, 对血清中TIGAR进行定量检测。但我们建立的方法尚存在不足, 即由于国内外尚无统一的TIGAR标准品, 本检测所采用的定量标准品为诱导自行构建的原核表达载体而获得的经纯化的融合蛋白。因此, 不同批次制备的TIGAR蛋白可能会存在一定的差异。作为临床检测抗原的制备尚需标准化, 抗体的制备和纯化方法也需改进, 以提高检测的敏感性。
本研究的检测结果显示, 肿瘤组血清中TIGAR含量明显高于对照组, 说明TIGAR可能在细胞转化的过程中被激活, 并且由胞浆分泌入血。若能进一步明确TIGAR与肿瘤的相关性, 则将大大提高TIGAR的临床诊断价值。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|