作者简介:陈雪娇,女,1977年生,学士,主管技师,主要从事实验室产前诊断研究。
通讯作者:陈 瑜,联系电话:0571-87236383。
三倍体是人类最常见的染色体异常疾病, 至少4%的妊娠(包括早孕流产)会发生三倍体[1]。18-三体综合征于1960年由爱德华首先描述, 所以又称爱德华综合征, 在孕中期和新生儿中的发生率分别为1/4 274和1/6 071~1/8 333 [2, 3], 是发生率仅次于21-三体综合征的常染色体病, 病情却甚于21-三体。最近报道18-三体其24 h和7、28、60、180、365 d的死亡率依次为14.84%、31.01%、56.25%、64.08%、82.17%和90.90%, > 1周岁的存活率为9.09%。对每例患儿进行重症监护治疗后, 则1年的存活率为25%, 平均寿命为152 d[4, 5]。对于已经出生的18-三体患儿, 即使他们患有心脏病, 国外超过44%的父母仍愿意给新生儿进行康复治疗[6], 因此做好18-三体的产前筛查和产前诊断是遗传工作者的一项重要工作。本研究就目前18-三体的产前筛查和产前诊断的临床应用做一个回顾性分析, 为临床遗传咨询提供依据。
产前筛查对象为2002年1月1日至2009年9月22日自愿到浙江省台州医院及台州地区其他妇保院体检的孕妇, 平均年龄(27.01± 0.35)岁, 血清标志物筛查时间为孕15~20+6周。产前诊断对象为产前筛查风险率≥ 1/350的孕妇、高龄孕妇及其他有遗传风险的孕妇, 羊膜腔穿刺时间为孕18~24周。每个孕妇被告知并签署知情同意书。
1.产前筛查方法 采用时间分辨免疫荧光试剂盒检测孕妇血清中甲胎蛋白(AFP)和游离β -人绒毛膜促性腺激素(hCGβ )的浓度值, 再结合孕妇的年龄、体重等因素, 由美国PerkinElmer公司生产的风险计算软件计算胎儿患18-三体的风险率。高危标准以1∶ 350为截断点。分析仪为VICTOR2D-1420。操作按说明书进行。
2.产前诊断方法 (1)接种:B超引导下经腹取羊水20~30 mL, 离心留取剩余约0.5 mL羊水的沉淀物, 混匀接种于含3.5 mL羊水培养基的培养瓶中, 37 ℃、5%CO2培养7 d; (2)换液:将整个培养瓶置于倒置显微镜下观察细胞贴壁情况, 出现7~8个克隆并有很多折光性强的胎儿细胞时进行换液, 未贴壁和贴壁少的患者选择继续培养; (3)胰酶消化洗脱:第8天时对换过液的培养瓶每瓶加入0.05 g/L秋水仙素150 μ L, 继续置于孵箱中培养45 min; 加入2 mL 0.25 %的胰酶37 ℃消化5 min, 收集洗脱液和继之清洗用的生理盐水清洗液, 1 700 r/min(离心半径为16 cm)离心7 min, 去掉上清液; (4)低渗:加入0.4%KCl和0.4%枸橼酸纳1∶ 1混匀的低渗液, 低渗5~8 min, 时间随室温调节; (5)固定:加入冰醋酸和甲醇以1∶ 3比例混匀的固定液0.5 mL, 预固定1~5 min, 离心同上, 弃上清, 再加固定液, 共固定3次; (6)滴片:留取0.5麦氏浓度左右的沉淀, 用冰片滴片, 烤干, 37 ℃过夜老化; (7)G显带:0.25 g/L的胰酶37 ℃显带(显带时间不定, 随季节经常会有变化), 吉姆萨染色; (8)核型分析:染色体核型分析用德国ZEISS Metasystems分析软件, 每例分析5个, 计数20个, 异常加倍。
| 表1 2002年1月至2009年9月台州地区产前筛查18-三体高危分布和产前诊断结果 |
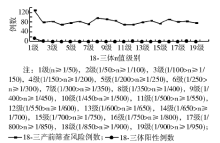
20世纪80年代母血清标记物应用于产前筛查, 初期人们主要用来筛查21-三体, 后来发现也可用于筛查18-三体, 而结合母亲年龄和生化指标(AFP、游离hCGβ )计算出来的n值检出率又明显高于先前的只根据生化指标计算出来的n值[7]。本研究从n值的角度对18-三体的产前筛查和产前诊断进行了分析, 尽管例数不是很多, 但已可初看端倪, 18-三体的n值变化规律完全不同于21-三体。21-三体的n值越高, 高危人群的比例越低, 同时21-三体确诊的阳性率越高, n值和阳性率呈明显正相关关系[8]。而18-三体的n值找不到21-三体的变化规律, n值越高, 阳性率也越高, 但相应的高危人群的比例不是偏低而是和后面级别持平甚至偏高一些。从表1可以看出在产前筛查高危孕妇中n值> 1/50的孕妇比例明显高于其余级别, 阳性病例也集中在1/100以内, 从图1可看出n值1/950以内的各级别的孕妇除了n≥ 1/50比例高些外, 其余分布似乎都比较接近。本实验室的17例经过产前筛查后确诊的阳性病例中有15例n值≥ /100(其中11例n值为1/10), 剩余2例阳性患者则在低危的高龄孕妇中被发现, 其中1例n值为1/600, 1例n值为1/880。据Benn等[7]报道, n值1/100以内18-三体的检出率和假阳性率分别为69%和0.45%, 提示n值1/100以内的18-三体的阳性率也很高, 这其中的具体机制还有待进一步研究。
母血清标记物AFP、游离hCGβ 在18-三体中均表现为低水平, 在21-三体中游离hCGβ 却高于正常平均水平, 我们对筛查过的孕妇的AFP、游离hCGβ 的平均MOM值作了一个统计, 其高危孕妇的MOM值为0.780、0.340, 和国外报道的高危MOM值很接近[9]。Palomaki等[9]发现对于筛查18-三体, AFP、游离hCGβ 、游离雌三醇(uE3)及年龄的预测能力由强到弱依次为uE3、游离hCGβ 、AFP、年龄, 其89例确诊孕妇的AFP、游离hCGβ 的平均MOM值为0.65、0.36。在筛查的低危孕妇中发现1例18-三体, 其n值为1/600, 年龄为37.6岁, AFP、游离hCGβ 的MOM值分别为1.01、0.27; 另1例n值为1/880, 年龄36.4岁, AFP、游离hCGβ 的MOM值分别为0.69、0.35。从她们的MOM值看, 她们的游离hCGβ 值明显低于低危孕妇的MOM值而接近于高危孕妇的MOM值, 此2例患者给了我们一个警示, n值接近截断值的患者, 应结合她的MOM值、B超、年龄及患者本身的状况再做一个综合的遗传风险评估, 而不是凭单一的指标就下定论。Kagan等[10]统计了包括122例18-三体的孕妇人群, 认为若结合母亲年龄、游离hCGβ 、妊娠相关血浆蛋白A及B超颈部半透明带厚度可以检出90%的21-三体和97%的18-三体, 假阳性率却不超过3.1%。
目前, 传统的染色体核型分析还是产前诊断18-三体的金标准, 但其既需要羊膜腔穿刺手术, 又需要漫长的培养等待, 因此人们也在积极探索无创性的快速诊断方法。如检测母血中循环胎盘mRNA的单核苷酸多态性的2个等位基因, 既无创又快速, 但需要样本量大[11], 或用引物原位标记(primed insitu labeling, PRINS)技术快速检测羊水细胞间期核的18-三体荧光信号, 但有研究显示4.2%样本无荧光信号, 即会造成假阴性[12], 因此18-三体的产前筛查和产前诊断的实验室工作尚待完善。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|