作者简介:蔡德丰,男,1979年生,学士,技师,主要从事脂代谢相关疾病研究。
通讯作者:陆元善,联系电话:021-63240090-4306。
饱和脂肪酸过多的摄入会引起多种代谢性疾病, 单不饱和脂肪酸具有重要的生理功能。硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase-1, SCD1)主要催化棕榈酰辅酶A和硬脂酰辅酶A去饱和为棕榈油酰辅酶A和油酰辅酶A, 从而减少饱和脂肪酸的量, 降低脂毒性。动物实验中我们观察到随着高脂喂养时间的延长, SD大鼠肝细胞SCD1表达下调及细胞凋亡增加, 线粒体膜电位(mitochondrium membrane potential, MMP)紊乱是细胞凋亡的重要特征。结合其他文献我们推测上调SCD1表达可能对缓解高脂引起的肝细胞凋亡有帮助, 为此我们设计如下实验。通过大鼠BRL肝细胞系和棕榈酸(PA)共培养, 以观察BRL肝细胞系SCD1表达变化、细胞凋亡及MMP的改变。然后通过已经构建成功的pGC-FU-SCD1-GFP慢病毒载体转染大鼠BRL肝细胞系, 检测在SCD1过表达状态下, 是否能够降低细胞内饱和脂肪酸引起的脂毒性和恢复MMP, 从而减少细胞的凋亡和膜电位的下降, 进一步阐明SCD1在肝细胞能量调节中的作用及其机制, 为临床非酒精性脂肪肝的治疗提供帮助。
1. 大鼠BRL肝细胞系 大鼠BRL肝细胞系购于上海中科院细胞所。
2. SCD1过表达慢病毒载体 pGC-FU-SCD1-GFP慢病毒载体已构建成功[1]。
3. 主要试剂 活体细胞膜功能(膜电位)荧光测定试剂盒购自上海杰美基因科技有限公司, 台盼兰购自上海捷倍思基因技术公司, PA、低脂肪酸的牛血清白蛋白V(BSA)购自美国Sigma公司, 引物合成于上海生工生物工程有限公司。
4. 仪器 FACS Calibur流式细胞仪为美国Becton Dickinson公司产品, 实时聚合酶链反应(PCR)仪为美国Stratagene产品。
1. PA溶液的配制[2] PA溶液为脂溶性, 必须有BSA助溶。称取372 mg PA溶解在5 mL无水乙醇中, 震荡5 min后完全溶解, 再加入5 mL双蒸水配制成母液, 将母液放进50 ℃恒温水浴箱孵育10 min。取母液1.334 mL溶解在含10% BSA的RPMI-1640培养基中, 至10 mL, 在37 ℃水浴箱搅拌, 待完全溶解, 超净台下微量滤器除菌, 然后溶解于改良Eagle培养基(DMEM)中, 配制0.2、0.4、0.8 mmol/L的PA孵育液, 并置4 ℃保存。
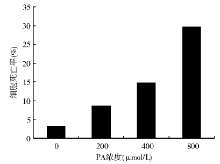
2.高脂诱导下BRL肝细胞死亡率检测 取24孔板接种细胞, 每组设9个复孔, 于培养箱中培养。当细胞融合率为50%时分组。以无PA培养的BRL细胞作为对照, 分别用200、400和800 μ mol/L的PA孵育液共培养72 h。胰酶消化, 0.4%台盼兰染色2~3 min。取细胞悬浮液滴加到细胞计数板, 静置15 min, 镜下观察, 计细胞死亡率。取细胞死亡率下降显著对应的PA浓度进行下游试验。
3.MMP的检测 实验分为加药组和非加药组。非加药组包括一般培养组(CON)、一般培养加阴性病毒组(NC)和一般培养加过表达病毒组(SCD1-LV); 加药组包括一般培养加PA组(CON+)、一般培养加阴性病毒和PA组(NC+)、一般培养加过表达病毒和PA组(SCD1-LV+)。每组接种1× 105个BRL细胞, 每组3个复孔, 实验重复3次。当细胞融合率达到30%时按照预实验复感染指数(MOI)=20加入适量的病毒液。72 h后收集细胞于15 mL尖底离心管; 加入500 μ L胰酶, 铺满整个培养孔, 消化移入15 mL锥形离心管, 2 590 r/min(离心半径为4 cm)离心5 min, 抽去上清液。加入50 μ L 清理液(reagent E), 混匀细胞颗粒群, 移入1.5 mL EP管中。加入450 μ L 含有GENMED染色液B(reagent C)和GENMED稀释液(reagent D)的染色工作液, 轻度涡旋震动几秒钟。37 ℃ 细胞培养箱孵育20 min(注意避光操作); 2 590 r/min(离心半径为4 cm)离心5 min, 抽去上清液。加入500 μ L清理液(注意检查前置于冰槽), 混匀后即刻进行流式细胞仪单通道分析。采用藻红蛋白(phycoerythrin, PE)通道, 激发波长488 nm, 散发波长575 nm。用发橙红色荧光细胞百分率(JC-1+%)表示MMP正常细胞比例。正常细胞有一定的红色荧光强度, 膜电位受到损伤时, 强度则显著减弱。
4. SCD1 mRNA检测 各组细胞模型建立方法同“ 方法3” 。细胞总RNA抽提和逆转录, 实时PCR检测SCD1表达, 引物序列为SCD1 上游引物:5'-AAAGAGAAGGGCGGAAAGC-3', 下游引物:5'-GTGTGGGCAGGATGAAGC-3'(115 bp); 3-磷酸甘油醛脱氢酶(glyceraldehyde 3 phosphate dehydrogenase, GAPDH)上游引物:5'-TTCAA-CGGCACAGTCAAGG-3', 下游引物:5'-CTCAGCA-CCAGCATCACC-3'(114 bp)。反应条件:预变性95 ℃ 15 s、变性95 ℃ 5 s、退火延伸60 ℃ 30 s, 45个循环; 每次在延伸阶段读取吸光度值。
采用SPSS 13.0软件进行分析, 所有数据以
随着PA浓度的增大和培养时间的延长, 细胞存活率有明显下降。与对照组相比, 400 μ mol/L PA处理72 h诱导了14.8%的细胞死亡(P< 0.01); 800 μ mol/L PA处理72 h诱导了29.6%的细胞死亡(P< 0.01)。见图1。
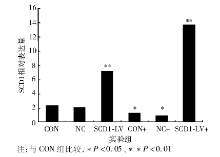
实时PCR结果显示, 与CON和NC组相比, CON+和NC+组SCD1 mRNA表达明显下降, SCD1-LV和SCD1-LV+表达上升, SCD1-LV+表达升高尤为明显。见表1和图2。
| 表1 各组BRL肝细胞SCD1表达分析结果 ( |
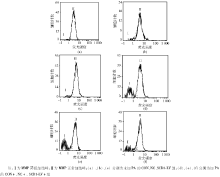
流式细胞分析仪结果显示不加PA的CON、NC和SCD1-LV组MMP正常细胞比例分别为97.9%、96.2%和96.8%; 加PA的CON+、NC+和SCD1-LV+组MMP正常细胞比例分别为76.8%、73.2%和88.5%。CON+、NC+组MMP正常细胞的比例明显下降, SCD1-LV+组JC-1+%高于CON+、NC+组(P< 0.05)。见图3。
脂质代谢异常是一种重要的代谢综合征, 涉及了非酒精性脂肪肝、肝硬化、心血管疾病、糖尿病和肥胖等多种疾病危险因素, 已经成为医学上研究的热点。脂毒性是指血中游离脂肪酸(free fatty acid, FFA)超过脂肪组织储存能力和各组织对FFA的氧化能力, 使过多的FFA以三酸甘油酯形式在非脂肪组织中过度沉积而造成对该组织的损伤。肝脏是脂代谢的最重要器官。FFA参与脂肪肝形成的同时造成了肝细胞凋亡损伤乃至坏死, 从而导致肝脏功能障碍。FFA包括饱和脂肪酸和不饱和脂肪酸。FFA除了作为机体功能的重要物质外, 其在细胞膜生物合成和细胞内信号转导过程中也具有重要的作用, 是重要的脂质毒性物质。饱和脂肪酸诱导的脂凋亡在多种细胞中也得到证实, 如中国仓鼠卵巢细胞[3]、心肌细胞[4]、乳腺癌细胞[5]及胰岛β 细胞[4]等。关于脂凋亡的机制存在多种学说, 但研究普遍认为FFA的脂凋亡作用与其饱和度有关。饱和脂肪酸如PA诱导β 细胞脂性凋亡, 而不饱和脂肪酸如油酸则较少细胞毒性, 并且能够保护饱和脂肪酸诱导的凋亡作用[6]。
本研究采用血浆中含量丰富的PA作为试验的干预因素诱导大鼠BRL肝细胞系凋亡, 用SCD1重组(pGC-FU-SCD1-GFP)慢病毒载体诱导SCD1的过表达, 探讨SCD1表达降低饱和脂肪酸引起细胞凋亡的机制。先用慢病毒感染72 h后加PA诱导。PA诱导72 h后, SCD1表达下降, 可能与高脂诱导后引起内源性高瘦素表达水平有关[7]; SCD1基因是瘦素信号的靶基因, 瘦素通过转录因子甾醇调节单元结合蛋白(sterol regulatory element binding protein, SREBP)[8]或神经肽(neuropeptide Y, NPY)[9]发生作用, 抑制SCD1基因的表达; 而SCD1-LV和SCD1-LV+组与CON及NC组相比, SCD1 mRNA表达明显上升(P< 0.01); 并且SCD1-LV+组比SCD1-LV组表达更为显著, 可能是由于PA刺激增强SCD1的表达。
MMP的形成主要与质子泵有关, 经三羧酸循环产生的还原型烟酰胺腺嘌呤二核苷酸(NADH)和还原型黄素腺嘌呤二核苷酸(FADH2)在氧化过程中, 其高能电子在呼吸链上传递, 释放的能量使质子(H+)通过线粒体内膜上的质子泵从线粒体内膜的基质侧移至膜间腔。线粒体内膜对H+不能自由通透, 从而在线粒体内膜两侧形成电化学质子梯度, 即膜电位, 通常反映线粒体膜通道(PTP孔)开放的情况。凋亡过程中, PTP孔的开放可使线粒体内膜通透性突然增加, 这种通透性可导致MMP的崩解。PTP孔的开放还可以使线粒体腔内的细胞色素C释放到细胞浆中, 细胞色素C与凋亡酶激活因子-1 (apoptotic protease-activating factor 1, Apaf-1)结合, 在脱氧腺苷三磷酸/腺苷三磷酸(ATP)存在时, 该复合物结合并激活半胱天冬酶9酶原, 再激活下游的半胱天冬酶(如半胱天冬酶3等)进而引发凋亡。线粒体是神经酰胺介导凋亡的靶器官[10, 11], 线粒体膜屏障受损的半胱天冬酶途径也是一个重要因素。Maedler等[12]发现PA可降低成年鼠β 细胞线粒体腺嘌呤核苷酸转位分子(ANT)的表达, ANT可催化ATP和腺苷二磷酸(ADP)通过内膜交换, ANT下降, 引起ATP和ADP交换受阻, 线粒体肿胀, 外膜受损, 胞内细胞色素C进入胞质, 激活半胱天冬酶途径, 引起细胞凋亡及MMP的紊乱。对培养的BRL肝细胞用流式细胞分析仪分析, 发现未加入PA的CON、NC、SCD1-LV组JC-1+%维持在较高的水平, 而PA刺激的CON+和NC+组JC-1+%显著下降, SCD1过表达PA刺激的SCD1-LV+组 JC-1+%明显高于CON+、NC+组, 但与CON组无明显差异。此结果表明, SCD1的过表达能够有效的催化PA为单不饱和脂肪酸, 使MMP的紊乱得到恢复, 从而降低脂毒性。
本研究以PA为干预因素, 诱导大鼠BRL肝细胞脂凋亡, 然后利用SCD1慢病毒载体过表达SCD1, 发现SCD1的过表达能够降低PA脂毒性, 纠正饱和脂肪酸引起的MMP下降, 说明SCD1可能通过维持线粒体膜的稳定降低饱和脂肪酸诱导的BRL肝细胞的凋亡, 为临床上治疗肝脏脂肪病变甚至代谢综合征提供了新的思路 。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|