通讯作者:徐瑞龙,联系电话:0579-82552088
作者简介:郑昭瞡,男,1974年生,硕士,主管技师,主要从事血液与免疫学检验工作。
分析银屑病患者外周血中CD3+CD(16+56)+自然杀伤T细胞(NK T)和CD3+CD4-CD8- 双阴性(DN)T细胞的变化。
方法应用三色流式细胞术分析结合CD45/侧向散射信号(SSC)和CD3/SSC设门分析外周血淋巴细胞亚群并应用Flow Count® 荧光球进行绝对计数。
结果银屑病组NK T细胞的比例3.58%±2.09%,显著低于健康对照组7.73%±5.8% ( P<0.01);银屑病组NK T细胞绝对数(72.68±51.18)细胞/mm3也显著低于健康对照(193.15±160.09)细胞/mm3( P<0.01)。银屑病组DN T细胞绝对数(78.92±58.67)细胞/mm3同样显著低于健康对照组(148.33±118.00)细胞/mm3 ( P<0.01);而其比例在两组间差异无统计学意义。银屑病组总T细胞(1 254.73±411.73)细胞/mm3和抑制性T细胞(Ts)(465.23±212.65)细胞/mm3均分别显著低于健康对照组[T:(1 721.72±712.45)细胞/mm3;Ts:(800.23±581.79)细胞/mm3], P值均<0.01,银屑病组CD4/CD8比值显著升高( P<0.05)。
结论银屑病患者外周血NK T细胞和DN T细胞显著减低。我们推测这两类细胞的异常减低与银屑病患者体内免疫调节功能失衡有关。
银屑病是临床常见的慢性炎症性皮肤疾病, 影响全球约2%~3%的人口[1, 2]。目前认为银屑病是一种免疫细胞和免疫介质-尤其是机体固有免疫和适应性免疫-与皮肤上皮和结缔组织之间的病态反应过程[2]。从表型特征和功能上看, 自然杀伤T细胞(natural killer T cells, NK T)是一群具有较高异质性的T细胞亚群[3]。NK T细胞以α /β 或γ /δ T细胞受体(TCR)和各种自然杀伤细胞(NK)受体的共表达为特征, 可以分泌1型、2型或两型细胞因子以影响Th0细胞的极化方向, 具有强大的免疫调控功能。CD3+CD(16+56)+细胞是NK T细胞群体的一员。外周血中同样存在数量稀少但功能独特的CD4-CD8-双阴性(double negative, DN)T细胞。有实验显示, DN T细胞是通过CD4基因静默的机制从外周淋巴细胞池中生成的具有强大免疫抑制功能的独特T细胞亚群[4, 5]。
本研究分析寻常型银屑病患者外周血NK T细胞和DN T细胞数量变化, 探讨这两类T细胞亚群在银屑病中的意义。
收集金华市中心医院皮肤科确诊为寻常型银屑病的初诊患者26例, 其中男15例, 女11例, 年龄(43.08± 14.05)岁。根据患者临床表现和病理特征进行银屑病的诊断和分型。同时收集年龄、性别匹配的健康体检者27名, 其中男13名, 女14名; 年龄(42.15± 15.05)岁作为对照组。健康体检者均经金华市中心医院体检中心排除血液/淋巴系统肿瘤、其他恶性肿瘤、结缔组织病等系统性疾病并经全面实验室检查确定无明显异常。
CD45-藻红蛋白-青色素5(PE-Cy5), CD3- PE-Cy5, IgG1-异硫氰酸荧光素(FITC)/IgG1-藻红蛋(PE), CD3-FITC/CD(16+56)-PE, CD4-FITC/CD8-PE, OptiLyse C, Flow Count® 荧光球均购自Beckman-Coulter公司。流式细胞仪为 Beckman-Coulter Epics XL四色流式细胞仪。
1. 标本 采集乙二胺四乙酸二钾(EDTA-K2)抗凝静脉血2 mL置室温待用。标本制备、数据获取在标本采集后4 h内完成。
2. 实验方法 在本实验中, 采用三色流式细胞术进行淋巴细胞亚群分析。按照生产商推荐剂量的荧光标记单克隆抗体与100 μ L全血混匀后室温、避光孵育15 min; 在每管中加入500 μ L溶血剂OptiLyse C, 混匀后室温、避光孵育10 min; 加入500 μ L/管鞘液, 混匀, 室温避光继续孵育10 min。在上机检测前, 每管加入100 μ L Flow Count® 荧光微球, 混匀后上机检测。流式细胞仪每日以Flow Check®进行光路、流路校正。以SSC/CD45和SSC/CD3设门分别圈定淋巴细胞和T细胞。NK T细胞以淋巴细胞的百分比表示; DN T细胞以T细胞的百分比表示, 绝对计数则以细胞/mm3 表示。
采用SPSS16.0软件进行数据统计分析。Pearson Chi-Square用于非参数分析, 独立样本t检验各组间的比较, P< 0.05为差异有统计学意义。
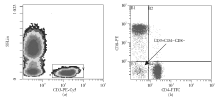
健康对照组和银屑病组NK T细胞比例分别为7.73%± 5.87%和3.58%± 2.09%, 两者间的差异有统计学意义(P< 0.01)。银屑病组NK T细胞绝对计数(72.68± 51.18)细胞/mm3, 明显低于健康对照组的(193.15± 160.09) 细胞/mm3(P< 0.01), 见图1。
银屑病组DN T细胞绝对数(78.92± 58.67)细胞/mm3也显著低于健康对照组(148.33± 118.00)细胞/mm3(P< 0.01), 见图2。而银屑病组DN T细胞比例6.27%± 3.52%与正常对照组8.59%± 5.72%间的差异无统计学意义。
本实验结果显示银屑病组NK T细胞比例和绝对计数均显著低于健康对照组。这一结果与Koreck等[6]的报道相一致。本实验和Koreck等均未分析银屑病患者病变皮肤组织中NK T细胞的分布情况, 因此不能排除NK T细胞向病变皮肤组织迁移而导致外周血NK T细胞的减低。Cameron等[7]发现银屑病病变皮肤组织CD161+ NK T细胞显著高于银屑病非病变皮肤和正常皮肤组织, 但CD56+细胞未见显著变化。Cameron等[8]未发现银屑病患者外周血CD3+ CD56+ CD57+细胞显著变化。
NK T细胞能够识别非多肽类抗原。体内应用神经酰胺可以诱导NK T细胞合成Th1型和Th2型细胞因子[9], 而重复剂量的神经酰胺则使NK T细胞向分泌Th2型细胞因子方向极化[ 10, 11]。因此, NK T细胞分泌的IL-4在促使Th0向Th2极化的过程中发挥主要作用。银屑病是以Th1型细胞因子分泌为特征的自身免疫性疾病。本实验及Koreck等的结果表明NK T细胞减少导致Th2反应低下可能是银屑病病理过程中持续的Th1型反应和角质细胞过度增生的重要原因。
Fischer等[12]发现TCRα β + DN T细胞促使Melan-A抗原特异性CD8+T细胞发生凋亡和增殖活性减低而发挥免疫抑制活性。Hamad等[13]报道B220+ DN T细胞抑制活化T细胞的增殖或白细胞介素-2(IL-2)、IL-10及γ -干扰素(IFNγ )的分泌, 在控制自身反应性T细胞的异常增殖方面发挥重要作用。本实验中我们没有进行DN T细胞的TCR表达分析, 因此不能确定银屑病组减低的DN T细胞是否属于TCRα β + DN T细胞。不过我们推测DN T细胞减少导致免疫抑制活性减低与银屑病免疫细胞异常活化密切相关。
总之, 本实验结果证实银屑病患者外周血NK T细胞数量显著减少, 同时伴有外周血DN T细胞数量的显著减少。我们推测银屑病患者外周血减少的NK T细胞和DN T细胞与银屑病患者机体免疫功能紊乱有关。进一步研究银屑病患者外周血中NK T细胞和DN T细胞的生物表型和功能特征将对了解银屑病的发病机制及探索银屑病免疫治疗的潜在靶标和途径具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|