通讯作者:张会英,联系电话:010-58517190。
作者简介:陈燕,女,1978年生,硕士,技师,主要从事免疫学检验工作。
骨关节炎(osteoarthritis, OA)是一种生物力学改建过程, 主要表现为关节软骨变性、破坏、软骨下骨硬化, 关节边缘和软骨下骨反应性增生、骨赘形成。可见软骨损伤是OA发病机制中的核心内容。而胶原是关节软骨中非常重要的成分, 占软骨干重的60%, 其中又以Ⅱ 型胶原为主, 胶原成分及其代谢产物的改变与OA病变密切相关。随着研究的不断深入, 部分胶原相关分子可能成为OA早期诊断、疗效评价、预测疾病进展的分子标志物。
在成熟的关节软骨中, 软骨的主要胶原是Ⅱ 型胶原纤维(CⅡ )。成熟的CⅡ 是由完全相同的3股α 链组成的三螺旋结构。CⅡ 最初以前体的形式合成, Ⅱ 型前胶原存在2种拼接方式:前胶原Ⅱ A和前胶原Ⅱ B。前胶原Ⅱ A在N末端有一段半胱氨酸富集区, 称为Ⅱ 型前胶原A氨基端前肽(procollagen type Ⅱ A N-propeptide, PⅡ ANP)[1], 主要见于前期软骨细胞和胚胎组织中。前胶原Ⅱ B的N末端缺乏这种半胱氨酸富集区[2], 主要存在于正常的成年软骨中。Ⅱ 型胶原前体剪切掉末端的前体肽, 经羟基化修饰后, 通过二硫键连接成三螺旋结构分泌至细胞外的软骨基质中。CⅡ 在基质金属蛋白酶(MMP)-1、8、13作用下, 在Gly794和Leu795之间进行剪切, 产生3/4长度和1/4长度2种片段[3], 同时CⅡ 的三螺旋结构解聚, 并被蛋白酶进一步的水解成小的肽段。
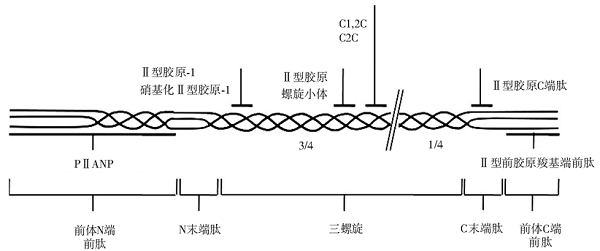
1. Ⅱ 型前胶原羧基端前肽(procollagen type Ⅱ C-terminal propeptide, PⅡ CP) Ⅱ 型胶原前体含有非螺旋结构的羧基(C)端前肽, 在胶原的成熟过程中, 前肽被剪切后释放入体液, 对其浓度的检测能够反应Ⅱ 型胶原的合成速率, 提示软骨的构建。OA患者早期为了修复损伤的软骨, 胶原合成代偿性增加, Shinmei等[4]的研究显示OA患者关节液中PⅡ CP水平与正常对照相比明显增高。提示关节液中PⅡ CP水平可以作为OA患者早期诊断的指标。另外, Lohmander等[5]的研究发现, 发生关节损伤的患者关节液中的PⅡ CP水平有所增加, 并在1~4年内达到高峰, 相较于正常对照高出2~4倍。对患者进行随诊检测发现, 关节损伤患者的关节液中PⅡ CP浓度达到峰值的同时, X光片显示患者关节发生了OA的改变。当疾病继续进展, 胶原的降解破坏> 其合成, 患者PⅡ CP浓度逐渐下降。因此, 监测PⅡ CP的变化可以作为OA患者疾病进展的指标。
2. PⅡ ANP PⅡ ANP为前胶原Ⅱ A氨基端的富含半胱氨酸的多肽片段, 前胶原Ⅱ A由软骨母细胞合成, 成熟的软骨细胞只能合成缺乏半胱氨酸富集区的前胶原Ⅱ B。Aigner等[6]研究发现OA患者软骨细胞中高表达前胶原Ⅱ A的mRNA, 而正常成年人软骨细胞中未见表达, 说明OA患者软骨细胞向未成熟阶段发生了表型的转化, 合成前胶原Ⅱ A, 这种表型转化被认为是一种细胞的恶变过程。然而, Rousseau等[7]研究发现, OA患者血清PⅡ ANP水平低于正常对照组。这种改变的临床意义仍值得商榷。
1. 经胶原酶剪切后剪切片段暴露的新识别表位 (1)Ⅱ 型胶原C末端新表位(CⅡ C-terminal neoepitope, TⅡ NE):TⅡ NE为Ⅱ 型胶原经胶原酶剪切后产生的3/4长片段所形成的新表位。TⅡ NE主要经肾排出体外, 能够在尿液中检测到, 而用酶联免疫吸附试验(ELISA)未在血清中检测到TⅡ NE 的存在, 可能是由于相对分子质量和理化性质影响了TⅡ NE 经肾小球滤过后的重吸收。Downs等[8]发现, OA患者尿液中TⅡ NE浓度远高于正常对照组。随访1年的OA患者通过连续检测尿液中TⅡ NE浓度, 发现TⅡ NE浓度的升高与X线显示的关节间隙狭窄程度成正相关。可见, 定期连续检测尿液中TⅡ NE浓度可作为OA疾病进展的监测指标[9]。(2)C1, 2C (COL2-3/4Cshort)和C2C(COL2-3/4Clong):两者是Ⅱ 型胶原3/4剪切片段的C末端新表位。C1, 2C对于Ⅱ 型胶原不具有特异性, Ⅰ 型胶原降解后也可产生, 而C2C只在Ⅱ 型胶原降解时产生。C1, 2C是C2C二次剪切的产物, 并能抵抗蛋白酶的进一步降解。软骨体外培养实验发现, OA患者的软骨在体外培养过程中能产生高水平的C1, 2C, 并能被胶原酶抑制剂所阻断[10]。Jordan等[11]发现, 经X线检查出患有膝关节OA的患者血清中C1, 2C水平相应增高。在OA的转基因鼠模型中, 鼠发生软骨损伤后所出现相应的临床表现要明显晚于C2C浓度的增加。通过18个月对患者的随访监测发现, OA患者体内C2C/PⅡ CP值与病情进展的相关性很高[12], C2C与胶原合成标志物PⅡ CP联合检测较单独检测C2C对于预测OA患者疾病的进展情况更为可靠。(3)Ⅱ 型胶原C端肽(CⅡ C-telopeptide, CTX-Ⅱ ):CTX-Ⅱ 为Ⅱ 型胶原1/4剪切体的C末端肽, 由于其相对分子质量较小, 容易经肾脏滤过, 由尿液排出体外。经检测, OA患者尿液中CTX-Ⅱ 水平明显高于正常对照组。Ishikawa等[13]、Oestergaard等[14]分别证明了胶原诱导的关节炎大鼠模型血液以及关节液中CTX-Ⅱ 明显增加, 大量数据显示CTX-Ⅱ 可以初步用于OA的早期诊断。同时CTX-Ⅱ 可以作为疾病进展及预后的指标。研究表明CTX-Ⅱ 的水平与关节的损伤密切相关。Reijman等[15]经过6年的随访, 发现在膝关节和髋关节的OA患者中, 病情进展风险高的患者体内CTX-Ⅱ 维持在较高的水平; 对于髋关节OA患者, 病情进展快的患者尿液中CTX-Ⅱ 的浓度要远高于病情进展慢的患者。早期的OA患者经核磁共振(MRI)观察的关节软骨缺损程度与尿液中CTX-Ⅱ 水平成正相关[16]。可见, CTX-Ⅱ 既可以用于OA的早期诊断又能预测疾病的进展。
2. 三螺旋结构解聚后的松弛螺旋暴露的新表位 (1)Ⅱ 型胶原-1(Coll 2-1)和硝基化Ⅱ 型胶原-1(Coll 2-1 NO2):Coll 2-1识别位点位于Ⅱ 型胶原螺旋区, 因为含有一个络氨酸残基, 被硝基化修饰后形成Coll 2-1 NO2, OA患者血清Coll 2-1和 Coll 2-1 NO2水平明显高于正常对照组, 尿中出现高浓度的Coll 2-1 和Coll 2-1 NO2的OA患者1年后X光片复查关节间隙较之前狭窄加剧[17], 但并没有数据显示这2个指标与关节损伤的X光片分级相关, 因此还不能作为疾病进展的标志物; (2)Ⅱ 型胶原溴化氰9.7肽(the CⅡ cyanogen bromide 9.7, CⅡ CnBr 9.7) 位于Ⅱ 型胶原1/4剪切片段上的溴化氢肽, 关节液中高浓度的CⅡ CnBr 9.7提示关节软骨存在严重的损伤。当患者关节出现急性损伤时, 关节液中的浓度会明显增加, 高于慢性损伤的OA患者和健康对照组[18]。因此, CⅡ CnBr 9.7可作为OA患者关节急性损伤的生物标志物; (3)Ⅱ 型胶原螺旋小体(Helix-Ⅱ ):Helix-Ⅱ 是Ⅱ 型胶原解螺旋后, α 螺旋结构域暴露后产生的新识别表位。与正常对照相比, OA患者尿中Helix-Ⅱ 的水平明显增加[19]。尿中Helix-Ⅱ 与CTX-Ⅱ 联合检查能够预测OA患者疾病的进展情况。
OA很难做到早期诊断, 往往诊断时关节损伤已较为严重, 延误了治疗。寻找早期诊断以及病情监测的生物标志物是当今研究的热点。Ⅱ 型胶原是构成软骨的重要成分, 而OA疾病中最重要的环节就是软骨的缺失, Ⅱ 型胶原代谢产物可能是OA很好的生物标志物。通过研究也证明了这一点, 并且通过联合检测多项指标可以提供更多的疾病信息。我们有理由相信, 随着检测技术的不断进步, 对OA研究的不断深入, 用于OA早期诊断和病情进展监测的好的生物标志物或标志物的组合将应用于临床, 而Ⅱ 型胶原代谢产物必是其中不可替代的一部分。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|

