通讯作者:胡付品,联系电话:021-52888186。
作者简介:应华永,男,1978年,学士,主管技师,主要从事细菌耐药机制研究。
了解浙江省金华市中心医院临床分离肺炎克雷伯菌中质粒AmpC酶和CTX-M型超广谱β-内酰胺酶(ESBLs)的发生率及其耐药性。
方法采用纸片扩散法(K-B)检测肺炎克雷伯菌对18种常用抗菌药物的敏感性。按美国临床实验室标准化研究所(CLSI)推荐的ESBLs表型确证试验检测;聚合酶链反应(PCR)检测菌株中的质粒AmpC酶基因和CTX-M型ESBLs基因。并对阳性扩增产物进行测序明确其基因亚型;接合试验了解质粒AmpC酶基因和ESBLs基因的可转移性;肠杆菌科细菌基因间重复一致序列(ERIC-PCR)分析菌株的同源性。
结果101株肺炎克雷伯菌中35.6%(36/101)的菌株ESBLs表型确证试验阳性,其中77.8%(28/36)的菌株含CTX-M型ESBL基因,以CTX-M-15和CTX-M-14基因型为主。11.9%(12/101)的菌株产质粒AmpC酶基因,DNA测序证实为DHA-1型质粒AmpC酶。5.9%(6/101)的菌株同时产质粒AmpC酶和ESBLs。
结论我院存在同时产质粒AmpC酶和ESBLs肺炎克雷伯菌的流行,质粒AmpC基因型别主要为DHA-1型,ESBLs基因型别主要为CTX-M-14或CTX-M-15型。耐药基因可通过接合的方式从供体菌转移至敏感细菌,临床上应加强对此类菌株的监测。
抗菌药物的广泛应用能有效地控制各种细菌的感染, 但由此导致细菌耐药的增加已成为人类面临的重大问题。肺炎克雷伯菌是引起临床细菌感染最常见的革兰阴性杆菌之一, 产超广谱β -内酰胺酶( ESBLs)和质粒AmpC酶是肺炎克雷伯菌对β -内酰胺类抗菌药物耐药的最主要的原因[1]。由于此类酶水解底物范围广, 且耐药质粒往往同时携带多种抗菌药物耐药基因, 呈现多重耐药的特点, 给临床抗感染治疗带来极大的挑战。据国内学者报道[2], 我国临床分离产ESBLs的肠杆菌科细菌中, CTX-M型ESBLs占绝大多数。本研究对浙江省金华市中心医院临床分离的肺炎克雷伯菌中CTX-M型ESBLs和质粒AmpC酶的发生率、主要基因型别及其耐药特点进行了分析。
1. 菌株来源 收集浙江省金华市中心医院2007年8月至2008年4月临床分离的101株非重复的肺炎克雷伯菌。质控菌株为大肠埃希菌ATCC 25922。大肠埃希菌J53为接合试验用菌株。聚合酶链反应(PCR)检测CTX-M型ESBLs基因和质粒AmpC酶阳性质控菌株为已经测序证实CTX-M-15型ESBLs以及同时产CTX-14型ESBLs和DHA-1型质粒AmpC酶基因的肺炎克雷伯菌, 上述产ESBLs或AmpC酶质控菌株均来自复旦大学附属华山医院抗生素研究所。
2. 仪器和试剂 VITEK32仪器和GNI鉴定系法国BioMerieux公司产品; TaKaRa PCR Thermal Cycler Dice(日本), 电泳槽、凝胶成像系统为美国Bio-Rad公司; PCR所需各类试剂由大连宝生物工程有限公司提供; 引物由上海生工生物技术公司合成; 叠氮钠为Sigma公司商品。
3. 抗菌药物 阿米卡星、庆大霉素、妥布霉素、氨苄西林、哌拉西林、头孢唑啉、头孢呋辛、头孢克罗、头孢西丁、头孢噻肟、头孢他啶、头孢吡肟、哌拉西林-他唑巴坦、头孢哌酮-舒巴坦、亚胺培南、美罗培南、环丙沙星、复方磺胺甲噁唑及头孢噻肟-克拉维酸、头孢他啶-克拉维酸等药敏纸片均为英国Oxoid公司商品。接合试验用氨苄西林粉剂为中国生物制品药品检定所标准品。
4. 培养基 药敏用MH琼脂和胰大豆蛋白胨水肉汤为英国OXOID公司产品, 科玛嘉尿道菌显色培养基干粉为郑州博赛公司商品
1. 药物敏感性试验 按美国临床实验室标准化研究所(CLSI)推荐的纸片扩散法(K-B)进行, 判断标准按2007年版CLSI文件。
2. ESBLs表型确证试验 按CLSI 2007年版推荐的确证试验进行。若酶抑制剂复方制剂与单药的抑菌圈直径之差≥ 5 mm则可判断为产ESBLs株, 若两者之差< 5 mm则为ESBLs阴性株。
3. 多重PCR检测101株细菌中的的ESBLs、质粒AmpC酶基因 煮沸法提取细菌DNA模板, 所用引物见表1(引物设计参见文献[3, 4])。(1)PCR检测ESBLs基因反应体系:反应体系共50 μ L。其中10× 缓冲液(Mg2+)5 μ L, dNTP 4 μ L, 每条引物各1 μ L, Tag酶0.25 μ L, ddH2O 37 μ L, 模板2 μ L。反应条件:预变性94℃× 5 min; 循环94℃× 45 s, 55℃× 45 s, 72℃× 1 min, 共30个循环; 最后延伸72℃× 10 min; (2)多重PCR检测质粒介导AmpC酶反应体系:反应体系共50 μ L。其中10× 缓冲液5 μ L(Mg2+)5 μ L, dNTP 4 μ L, MOX-F/R 0.6/0.6 μ L, CIT-F/R 0.6/0.6 μ L, DHA-F/R 0.6/0.6 μ L, ACC-F/R 0.5/0.5 μ L, EBC-F/R 0.5/0.5 μ L, FOX-F/R 0.4/0.4 μ L, Tag 酶0.25 μ L, ddH2O 32.5 μ L, 模板2 μ L。扩增条件:预变性94℃× 5 min; 循环94℃× 45 s, 64℃× 45 s, 72℃× 1 min, 共30个循环; 最后延伸72℃× 10 min; (3)PCR产物电泳:1.2%琼脂糖, 130V, 电泳35 min, 溴化乙锭染色20 min, 最后在凝胶成像系统上拍照阅读结果。
| 表1 PCR检测CTX-M-14型和CTX-M-15型ESBLs及DHA型质粒AmpC酶所用引物序列 |
4. DNA测序 PCR阳性扩增产物送上海生工生物技术公司进行纯化和测序。
5. 接合试验 按文献进行[5]。100 μ L的菌液涂布于含200 μ g/mL叠氮钠和50 μ g/mL氨苄西林的MH琼脂平板上, 同时设置供受体细菌在药物选择性平板上的生长对照以及非选择性平板上的菌落计数。35 ℃室温孵育24~48 h后挑取药物选择性平板上生长的单个菌落接种于不含药的CHROMagar产色琼脂培养基(郑州博赛公司商品), 35 ℃培养16~18 h, 判断是否有接合子存在。若在科玛嘉尿道显色培养基上生长为粉红色菌落者可能为供体菌与受体菌的接合子, 分离菌落, 进行药敏试验及PCR检测。
6. ERIC-PCR同源性分析 按文献[6]进行。细菌DNA的提取采用煮沸法, 引物序列为ERIC2:5'-AAGTAAGTGACTGGGGTGAGCG-3', ERIC-PCR反应条件 :预变性95 ℃× 5 min; 第一次循环94 ℃× 60 s, 26 ℃× 60 s, 72 ℃× 2 min, 共4个循环; 第二次循环94 ℃× 30 s, 40 ℃× 30 s, 72 ℃× 60 s, 共40个循环; 最后延伸72 ℃× 10 min。PCR产物经2%琼脂糖95V电泳100 min, 溴化乙锭染色20 min后在凝胶成像系统上拍照阅读结果。
除亚胺培南和美罗培南外, 产ESBLs菌株对包括广谱β -内酰胺类及其含酶抑制剂复合物、氨基糖苷类、复方磺胺甲噁唑、喹诺酮类等在内的多种抗菌药物均比非产ESBLs菌株表现出更高的耐药性, 但对头孢西丁的耐药率相同。ESBLs菌株表型确证试验检测结果显示, 35.6%(36/101)的菌株为产ESBLs株。其中产CTX-M-15型ESBLs菌株对头孢吡肟、头孢他啶的耐药性高于产CTX-M-14型ESBLs菌株, 见表2。
| 表2 产ESBLs和非产ESBLs肺炎克雷伯菌对常用抗菌药物的耐药性比较[株(%)] |
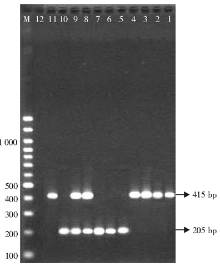
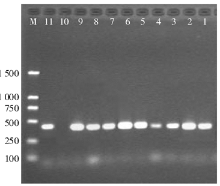
101株肺炎克雷伯菌中, PCR检测及DNA测序结果显示, 14株含CTX-M-14型基因, 9株含CTX-M-15型基因, 5株同时含CTX-M-14和CTX-M-15型基因, 仅有8株ESBLs表型确认试验阳性菌未检测到CTX-M型基因, 可能为其他基因型别的ESBLs。65株ESBLs表型确认试验阴性的菌株均未检测到CTX-M型基因。PCR检测CTX-M型基因结果见图1。
AmpC基因扩增结果, 11.9%(12/101)的菌株检测到DHA基因, DNA测序结果证实全部为DHA-1亚型。12株产DHA-1型质粒AmpC酶的菌株中, 2株分别伴有CTX-M-14型或CTX-M-15型ESBLs, 见图2。
分别选择单产CTX-M-14、CTX-M-15型ESBLs和单产DHA-1型质粒AmpC酶基因的肺炎克雷伯菌各2株, 同时产CTX-M-14、CTX-M-15型ESBLs和产DHA-1型质粒AmpC酶基因的肺炎克雷伯菌各1株进行质粒转移接合试验。结果除1株单产CTX-M-14型ESBLs和1株单产DHA-1型质粒AmpC酶基因的菌株外, 其余6株肺炎克雷伯菌的DHA和CTX-M基因均能通过接合试验成功转移到受体菌大肠埃希菌J53中。
对101株肺炎克雷伯菌的同源性分析绝大多数菌株不具有同源性。CTX-M型ESBLs基因和DHA-1型质粒AmpC酶基因阳性菌株间不存在同一克隆菌株的传播流行。
质粒AmpC酶和产CTX-M型ESBLs目前已成为肺炎克雷伯菌对新型广谱β -内酰胺类抗菌药耐药的最主要的机制。ESBLs主要由质粒介导, 而AmpC酶最初被认为仅由染色体介导, 但近几年临床上不断分离到产质粒介导AmpC酶的肺炎克雷伯菌耐药株。由于编码这两种酶的耐药质粒可在细菌间进行传播, 导致耐药菌株引起医院感染的爆发流行[7, 8], 因此了解这两类耐药基因在我院的流行情况及基因型别显得格外重要。
无论是单产AmpC酶还是单产ESBLs 的菌株对第三代头孢菌素、单环β -内酰胺类均高度耐药, 前者还对头霉素类耐药, 后者则多敏感。临床上常用的β -内酰胺酶抑制剂他唑巴坦、克拉维酸和舒巴坦对ESBLs有较强的抑制作用, 而对AmpC酶的抑制作用较弱。如果同时产这两类酶, 将使细菌的耐药表型变得更为复杂。本组资料显示, 我院临床分离的肺炎克雷伯菌中ESBLs和质粒AmpC酶的检出率分别为35.6%(36/101)和11.9%(12/101), 与温州、宁波等学者报道的相近[9, 10], CTX-M型ESBLs的基因型以CTX-M-15和CTX-M-14型为主, 而质粒AmpC基因型则主要为DHA-1型。需要重视的是, 在本次研究中, 我们检测到了6株(5.9%)同时产ESBLs和AmpC酶的菌株, DNA测序结果显示, 2株产DHA-1型质粒AmpC酶的菌株分别同时产CTX-M-14型ESBL或CTX-M-15型ESBL。质粒转移接合试验结果显示, 携带有CTX-M型ESBLs基因和(或)DHA-1型质粒AmpC基因的肺炎克雷伯菌, 可通过接合的方式, 将耐药基因转移至受体菌, 说明耐药性的传递, 可以通过细菌与细菌之间的直接接触而完成。
药敏试验结果显示, 产ESBLs株对临床常用抗菌药物的耐药率远高于非产ESBLs株, 但两者对头霉素类抗菌药头孢西丁的耐药率相仿, 显示此类抗菌药对产ESBLs菌株的良好的抗菌活性。值得注意的是, 我们在对2种产不同CTX-M型ESBLs菌株的耐药性分析中发现, 产CTX-M-15型ESBLs菌株对头孢他啶和头孢吡肟的耐药性高于产CTX-M-14型ESBLs菌株。过去的研究认为产CTX-M型ESBLs主要对头孢塞肟和头孢曲松等具有较强的水解活性, 却不能水解头孢他啶[11]。但近年来对CTX-M-15酶学特征的研究发现, 其与CTX-M-14的不同点主要在于前者Asp240氨基酸突变, 使酶具有水解头孢他啶的活性[12]。本实验的药敏结果也证实了这一点, 但其对头孢吡肟也具有更高的耐药性的原因目前尚未有相关报道, 有待我们在今后的实验中进一步的研究。
由于本研究资料仅限于不到1年的菌株, 研究结果尚不能完全体现我院临床分离肺炎克雷伯菌中的CTX-M型ESBLs基因和质粒AmpC酶基因的流行情况, 亦未能说明产ESBLs和(或)AmpC酶菌株的检测率是否在本院有逐年增加的趋势, 这些工作有待于我们进一步深入的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|