作者简介:由然,女,1975年生,硕士,主管技师,主要从事细菌耐药研究
了解耐阿米卡星(AMK)铜绿假单胞菌(Pa)的氨基糖苷类修饰酶基因和氨基糖苷耐药基因的存在情况及其基因型。
方法对临床分离的72株多重耐药Pa(其中对AMK耐药Pa组和对AMK敏感Pa组各36株)分别用聚合酶链反应(PCR)测定9种主要的氨基糖苷类修饰酶基因和2种氨基糖苷耐药基因,用基因外重复回文序列(REP)-PCR进行基因型研究。
结果在分组研究中AMK耐药Pa组表现为aac(6')-Ⅰ和aac(3)-Ⅱ基因同时阳性的占42.4%,aac(6')-Ⅰ和ant(2″)-Ⅰ基因同时阳性的占36.4%,是耐药组的主要修饰酶基因;AMK敏感Pa组表现为aac(6')-Ⅰ基因阳性的占50.0%, aac(3)-Ⅱ基因阳性的占33.2%,是敏感组的主要修饰酶基因。2种氨基糖苷耐药基因(RmtA和RmtD)均为阴性。REP-PCR显示耐药菌株可分为A~G 7型,其中AMK耐药Pa组的主要分型为F型(其中尤以F1型为多);AMK敏感Pa组以E型为多见。
结论通过2种或多种氨基糖苷类修饰酶同时作用于AMK是Pa对AMK耐药的重要途径之一。
To study the existing situation and genotyping of aminoglycoside modifying enzyme gene and aminoglycoside resistance gene of amikacin(AMK)-resistant mechanism in Pseudomonas aeruginosa (Pa).
Methods72 strains of mutli-resistant Pa, including 36 AMK-resistant Pa and 36 AMK-sensitive Pa, were detected for 9 main kinds of aminoglycoside modifying enzyme gene and 2 aminoglycoside resistance genes by polymerase chain reaction (PCR). The genotyping was analyzed and investigated by repetitive extragenic palindromic (REP)-PCR.
ResultsIn AMK-resistant Pa group, there was 42.4% for aac(6')-Ⅰand aac(3)-Ⅱ genes both positive, and there was 36.4% for aac(6')-Ⅰand ant(2″)-Ⅰgenes both positive which were the main modifying enzyme genes in resistant group. In AMK-sensitive Pa group, aac(6')-Ⅰgene positive was 50.0%,and aac(3)-Ⅱgene positive was 33.2%. They were the main modifying enzyme genes in sensitive group. 2 kinds of aminoglycoside resistance genes (RmtA gene and RmtD gene) were not found. The results of REP-PCR showed that there were 7 types from A to G. In AMK-resistant Pa group, the main genotyping was F (especially F1). In AMK-sensitive Pa group,the main genotyping was E.
ConclusionsIt's one of significant ways of AMK-resistant mechanism in Pa that two or more than two aminoglycoside modifying enzymes act on AMK simultaneously.
阿米卡星(AMK)是氨基糖苷类抗菌药物, 对铜绿假单胞菌(Pa)有较好的抑菌作用, 据北京大学第一医院2005年度细菌耐药监测数据显示, AMK敏感性高达95%。但近年来, 随着氨基糖苷类抗菌药物在临床的大量使用, Pa对其耐药性已呈不断上升的趋势。2006至2007年度据卫生部全国细菌耐药监测网统计, Pa对AMK的耐药率已达21.3%~28.8%[1]。据北京大学第一医院监测统计, 虽然2005至2006年Pa对AMK的耐药率还仅为5%~6%, 但2007年已迅速上升至14%。为了解AMK的耐药机制, 我们对其耐药基因及其基因型作了初步探讨。
1. 菌株来源和鉴定 选取北京大学第一医院4个重症监护病房(ICU)2007年4月至2008年12月临床分离的72株多重耐药的Pa, 均采用phenix和Vitek鉴定系统鉴定菌株。标准菌株为Pa(ATCC 27853)。
2. 分组 根据 2008年版美国临床实验室标准化研究所(CLSI)文件标准进行抗菌药物敏感性判断, 最低抑菌浓度(MIC)值由琼脂稀释法确定, 72株多重耐药的Pa分为AMK敏感Pa组(AMK MIC≤ 16 mg/L)和AMK耐药Pa组(AMK MIC≥ 64 mg/L)各36株。
1.DNA提取 采用煮沸法。挑取纯培养菌落于1.5 mL离心管内 (其内已预置100 μ L超纯水), 100 ℃水浴5 min, 冰浴5 min, 20 000 r/min(离心半径为8 cm)离心10 min, 取上清液作为模板液, 置于-20 ℃冰箱备用。
2.氨基糖苷类修饰酶基因检测 9种氨基糖苷类修饰酶基因的聚合酶链反应(PCR)扩增引物见表1[2], 引物合成由北京诺赛基因公司完成。PCR扩增体系为:每反应体系灭菌双蒸水 9.5 μ L, P1、P2 引 物 各 1 μ L, Taq Mix 12.5 μ L, 模板液 1 μ L, 总反应体积 25 μ L。热循环参数为:93 ℃预变性5 min, 然后 93 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 30 s, 循环35周期 , 最后72 ℃延长至7 min。扩增产物经 1.2% 琼脂糖凝胶电泳, 溴化乙锭(EB)染色, 凝胶成像系统分析结果。扩增产物送北京诺赛基因公司测序, 测序结果与Pubmed Blast比对。
3. 氨基糖苷耐药基因检测 RmtA和RmtD的 PCR扩增引物见表2[3, 4], 引物合成由北京诺赛基因公司完成。PCR扩增体系为:每反应体系灭菌双蒸水 9.5 μ L, P1、P2 引 物 各 1 μ L, Taq Mix 12.5 μ L, 模板液 1 μ L, 总反应体积25 μ L。热循环参数为:96 ℃预变性5 min, 然后 96 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 循环35周期, 最后72 ℃延长至5 min。扩增产物经 1.2% 琼脂糖凝胶电泳, EB染色, 凝胶成像系统分析结果。扩增的产物送北京诺赛基因公司测序, 测序结果与Pubmed Blast比对。
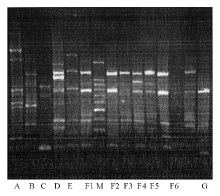
4.基因分型 基因外重复回文序列(REP)-PCR扩增引物见表2[5], 引物合成由上海英骏基因公司完成。扩增体系为:每反应体系灭菌双蒸水22 μ L, P1、P2引物各1 μ L, Taq Mix 25 μ L, 模板液 1 μ L, 总反应体积50 μ L。热循环参数为:94 ℃预变性10 min, 然后94 ℃ 1 min, 45 ℃ 1 min, 72 ℃ 2 min, 循环30周期, 最后72 ℃延长至16 min。扩增产物经 1.5% 琼脂糖凝胶电泳, EB染色, 凝胶成像系统分析结果。如果主条带位置完全相同则为同一分型, 若主条带位置相同而副条带有1~2条带不同则为不同亚型, 不满足上述条件者为不同分型[5]。
| 表1 9种氨基糖苷类修饰酶基因的 PCR扩增引物 |
| 表2 RmtA、RmtD基因和REP-PCR扩增引物 |
72株多重耐药Pa中, 有51株检出氨基糖苷类修饰酶基因。在AMK耐药Pa中, 有33株(91.7%)检出氨基糖苷类修饰酶基因, 其中同时检出aac(6')-Ⅰ 和ant(2″)-Ⅰ 基因的有12株(36.4%); 同时检出aac(6')-Ⅰ 和aac(3)-Ⅱ 基因的有14株(42.4%); 同时检出aac(6')-Ⅰ 、aac(3)-Ⅱ 和ant(2″)-Ⅰ 基因的有2株(6.1%); 仅检出aac(6')-Ⅰ 基因的有1株(3.0%); 仅检出aac(3)-Ⅱ 基因的有1株(3.0%); 仅检出ant(2″)-Ⅰ 基因的有3株(9.1%)。在AMK敏感Pa中, 有18株(50.0%)检出氨基糖苷类修饰酶基因, 其中同时检出aac(6')-Ⅰ 和ant(2″)-Ⅰ 基因的有1株(5.6%); 同时检出 ant(2″)-Ⅰ 和aac(6')-Ⅱ 基因的有1株(5.6%); 仅检出aac(6')-Ⅰ 基因的有9株(50.0%); 仅检出aac(3)-Ⅱ 基因的有6株(33.2%); 仅检出ant(2″)-Ⅰ 基因的有1株(5.6%)。另外5种氨基糖苷类修饰酶基因aac(3)-Ⅰ 、aac(3)-Ⅲ 、aac(3)-Ⅳ 、aph(3')-Ⅵ 和ant(3″)-Ⅰ 均表现为阴性。
在32株分离自呼吸科ICU(RCU)的菌株中, 对AMK耐药的有26株, 其中有21株检测到aac(6')-Ⅰ 与ant(2″)-Ⅰ 基因同时阳性和aac(6')-Ⅰ 与aac(3)-Ⅱ 基因同时阳性的氨基糖苷类修饰酶基因; 而对AMK敏感的有6株, 未检测到aac(6')-Ⅰ 与ant(2″)-Ⅰ 基因同时阳性和aac(6')-Ⅰ 与aac(3)-Ⅱ 基因同时阳性的氨基糖苷类修饰酶基因。
2种氨基糖苷耐药基因(RmtA和RmtD)均为阴性。
AMK是氨基糖苷类半合成抗菌药物, 其抗菌谱是氨基糖苷类抗菌药物中最宽的。氨基糖苷类修饰酶是Pa产生耐药的重要原因之一, 主要作用于氨基糖苷类抗菌药物的特定氨基或羟基, 竞争细菌细胞内转运系统, 并使其丧失干扰核糖体的功能[6]。氨基糖苷类药物的修饰酶通常由质粒和染色体携带, 由可移动遗传因子介导, 使耐药性在同种或异种细菌间转移[7]。
在AMK分组研究中发现, 耐药Pa组有33株检测出修饰酶基因, 而敏感Pa组仅18株阳性, 其中AMK耐药Pa组33株阳性中有28株检出2种或3种基因同时存在, 而AMK敏感Pa组仅2株有此现象。尤其有意义的是AMK耐药Pa组中检出aac(6')-Ⅰ 与ant(2″)-Ⅰ 基因同时阳性和aac(6')-Ⅰ 与aac(3)-Ⅱ 基因同时阳性的复合酶基因26株, 而AMK敏感Pa组仅有1株。这些现象提示:(1)对AMK的耐药, 仅仅1种修饰酶可能是不够的, 往往需2种或多种修饰酶同时作用才可引发对AMK耐药; (2)aac(6')-Ⅰ 基因是Pa对AMK耐药的最重要的修饰酶基因, 在36株耐药菌株中有29株检到aac(6')-Ⅰ 基因, 并且在具备这种乙酰转移酶基因的基础上, 还应具备另一种乙酰转移酶基因aac(3)-Ⅱ 或核苷转移酶基因ant(2″)-Ⅰ 才能形成对AMK的耐药。
目前常见的修饰酶基因有aac(6')-Ⅰ 、aac(3)-Ⅱ 、ant(2″)-Ⅰ 、aac(6')-Ⅱ 、aac(3)-Ⅰ 、aac(3)-Ⅲ 、aac(3)-Ⅳ 、aph(3')-Ⅵ 和ant(3″)-Ⅰ 共9种。本研究检测到前4种基因, 与国内的流行基因型基本相同[810]。氨基糖苷类修饰酶基因检出率aac(6')-Ⅰ > aac(3)-Ⅱ > ant(2″)-Ⅰ > aac(6')-Ⅱ , 这可能与不同修饰酶与AMK的结合部位不同而对AMK的修饰作用强弱有关。
2008年9月韩国Kim等[11]报道Pa对AMK的耐药率已达22%, 且发现了4种氨基糖苷类修饰酶基因[aph(3')-Ⅵ 、ant(2″)-Ⅰ 、aac(6')-Ⅰ 和aac(3)-Ⅱ /Ⅵ ], 且36%同时存在2种氨基糖苷类修饰酶基因。此报道与我们的研究结果基本相同。
2003年和2007年日本和美国研究者先后发现多重耐药Pa的新耐药基因RmtA和RmtD, 且证实这2种基因的表达使细菌对AMK等产生耐药[3, 4]。目前我国尚未见Pa的这2种基因阳性报道。本研究对这2种基因进行筛查的结果均为阴性, 表明我们研究的耐药Pa不含有RmtA和RmtD基因。
REP-PCR目前被广泛应用于多种细菌基因分类, 本研究菌株可分为A~G 7型, 其中F型又可分F1~F6 6个亚型。表3显示AMK耐药Pa组以RCU分离株最多见, 其基因多为F型, 其他ICU的耐药菌基因型分布较为分散; 而AMK敏感Pa组以干ICU最多, RCU和SICU次之, 基因型分布相对较为分散, 主要为E型。结合菌株分离时间及基因型结果提示, 病房内部存在水平传播, 如不加以重视不能避免院内感染的发生。
经病案查询发现, 大多数患者在分离菌株前使用过抗菌药物(尤其是碳青霉烯类和氨基糖苷类), 也有少部分局部使用过AMK。这些都使得细菌有机会产生耐药(修饰酶、外排泵等), 所以控制耐药菌株的产生和播散具有重要意义。综上所述, 2种或多种氨基糖苷类修饰酶的同时作用是目前Pa对AMK耐药的重要机制。这种AMK耐药的Pa常同时表现为头孢类、碳青霉烯类及喹诺酮类药物的多重耐药, 并易在病房流行扩散。在临床工作中应注意合理应用抗菌药物, 加强医院感染控制, 防止耐药菌的产生与传播。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|