作者简介:奕泉根,男,1956年生,主管技师,主要从事生化实验工作。
一些研究表明体液中的尿激酶型纤溶酶原激活物(urokinase type plasminogen activator, u-PA)和尿激酶型纤溶酶原激活物受体(urokinase type plasminogen activator receptor, u-PAR)浓度与癌细胞自身分泌和释放及其浸润转移有关[1~3]。原发性肝癌是临床上常见的又与乙型肝炎(简称乙肝)后肝硬化有关的癌症。我们研究检测乙肝后肝硬化和肝癌患者血浆以及肝癌组织浸液中的u-PA、u-PAR水平, 探讨肝硬化进展为肝癌过程中u-PA、u-PAR的改变及其临床病理学意义。
1. 研究对象及分组 乙肝后肝硬化组31例, 男17例, 女14例, 年龄34~77岁, 诊断符合1995年全国传染病及寄生虫病学术会议修改的诊断标准; 乙肝病毒阳性原发性肝癌组24例, 均为住院患者, 男16例, 女8例, 年龄37~80岁, 每例均经病理活检确诊, 其中手术切除16例, 按组织病理检查分为原发性肝癌肝邻近组织硬化(10例)和邻近肝癌组织非硬化(16例)2组; 对照组30名, 男19名, 女11名, 年龄30~69岁, 均为体检健康的本院在职及退休职工。
2. 标本采集和处理 早晨空腹静脉采血3 mL, 先取0.9 mL注入含0.109 mol/L枸橼酸钠抗凝液0.1 mL的试管中, 轻摇, 分离血浆保存于-70 ℃冰箱待测。组织标本取自手术切除的新鲜癌组织和邻近的非癌组织, 在30 min内将组织剪成细小碎块, 以每克湿重组织加0.01 mol/L磷酸盐缓冲液(pH值7.2)2 mL的比例, 用细胞匀浆器或研钵充分研碎。然后将组织匀浆倒入塑料试管, 4 ℃过夜, 4 000 r/min(离心半径15 cm)离心5 min, 取上清液分装于2支塑料试管并保存于-70 ℃待测。
3. 检测方法 u-PA和u-PAR测定用酶联免疫吸附试验(ELISA), 试剂为美国ADI公司产品, 操作严格按照说明书进行; 用ELISA检测仪(Bio-Rad Model 450 Microplate Reader USA)测定波长450 nm处的吸光度值。绘制不同浓度标准品与吸光度值的标准曲线, 根据标准曲线计算血浆u-PA和u-PAR的浓度。
4. 统计学方法 实验数据用 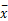
1. 血浆u-PA和u-PAR水平 肝癌患者血浆u-PA和u-PAR水平明显高于肝硬化组(P< 0.01)。肝硬化患者中, 失代偿期高于代偿期患者(P< 0.01), 后者u-PA水平虽高于正常对照组, 但差异无统计学意义(P> 0.05)。见表1。
表1 肝硬化和肝癌患者血浆u-PA、u-PAR浓度(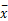 ± s, ng/L) ± s, ng/L) |
2. 组织浸液u-PA和u-PAR水平 在非硬化组中, 肝癌组织浸液的u-PA和u-PAR浓度明显高于邻近非癌组织。在硬化组中, 肝癌组织的u-PA和u-PAR浓度则为低值, 不但低于其邻近的非癌组织, 而且明显低于非肝硬化组的肝癌组织(P< 0.01)。见表2。
表2 肝癌组织及其邻近非癌组织浸液u-PA、u-PAR浓度(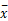 ± s, ng/L) ± s, ng/L) |
原发性肝癌有明确肝病史者占36.2%, 伴有肝硬化者占53.9%~85.0%, 肝硬化伴有肝癌者占9.9%~16.6%。u-PA是一种丝氨酸蛋白酶, 能使纤溶酶原转变为纤溶酶, 后者能活化金属基质蛋白酶降解细胞外基质, 形成细胞外局部溶解区, 从而构成细胞转移的通道。u-PA在体内的作用有赖于细胞膜上相应的u-PAR表达, u-PAR与u-PA结合后能增强肿瘤细胞浸润的能力。肝硬化是因为细胞外基质合成和降解失衡, 与u-PA有关。因此, u-PA和u-PAR不仅仅是调节局部纤溶活性, 而且参与细胞与细胞, 细胞与细胞外基质的多种生理病理过程, 如创伤愈合、血管新生和癌转移等[4]。由于恶性肿瘤大多表达u-PA和u-PAR, 故多种肿瘤细胞自分泌的u-PA及其作用与肿瘤细胞的某些生物学行为有着密切的关系, 并且u-PA和u-PAR的高表达还与患者的预后有关。本研究发现, 血浆u-PA和u-PAR水平在乙肝后肝硬化代偿期、失偿期和肝癌患者中呈现出递度性增高, 表明患乙肝后随着肝纤维化程度的加深, u-PA和u-PAR浓度逐渐增高。这一结果与Zhang等[5]在鼠肝硬化实验中发现肝纤维化时便出现组织表达u-PA和u-PAR明显增高的实验结果相符, 在肝纤维化中有u-PA纤溶的机制参与。乙肝病毒阳性肝癌患者u-PA和u-PAR水平比肝硬化的水平更高, 提示乙肝后肝硬化进展为肝癌中仍有u-PA纤溶的机制参与。
闵军等[7]报道肝癌组织u-PA和u-PAR显著高于邻近非癌组织, 可能在癌浸润和转移中起重要作用。Chan等[8]报告肝癌组织u-PA过度表达可提示肿瘤侵润性。我们以癌旁非癌组织为对照, 检测癌组织浸液中的u-PA和u-PAR浓度, 发现肝癌伴邻近组织硬化组和非硬化组之际间有着显著的不同。非硬化的肝癌组织u-PA和u-PAR浓度均显著高于其邻近非癌组织, 表明癌组织有高表达u-PA和u-PAR的功能。相反, 邻近组织硬化组中, 肝癌组织的u-PA和u-PAR浓度, 却出现癌组织低于其邻近的非癌组织, 同时又显著低于邻近组织无肝硬化的肝癌组织。而上述2组在非癌组织之间的u-PA和u-PAR水平则不见明显差异。认为同为肝癌组织在有无硬化组间存在u-PA和u-PAR水平如此大的差异, 可能反映出肝细胞癌发生机制上的某些不同。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|

