通讯作者:张宏印,联系电话:010-62759010。
作者简介:徐京昕,女,1966年生,副主任技师, 主要从事临床检验工作。
评价流式荧光免疫法在多肿瘤标志物定量测定中的可靠性。
方法用流式荧光免疫法对试剂盒精密度、线性、携带污染率、抗干扰性等指标进行评价,同时将LuminexTM-100与Bio-Ekon SerozymeⅠ的结果进行比较。
结果本方法化学性能的评价表明,批内变异系数( CV)均<10%,批间 CV均<14%。线性良好( r>0.99)。携带污染率均<0.5%。血红蛋白(Hb)、胆红素(Bil)、三酰甘油(TG)对测定结果无显著干扰( P>0.05)。与Bio-Ekon SerozymeⅠ 内分泌定量分析仪及配套试剂相关性良好( r>0.975)。对506名年龄在24~84岁健康体检人员标本用本方法进行多肿瘤标志物测定,正常参考值分别为甲胎蛋白(AFP)<15 ng/mL、糖类抗原125(CA125)<35 U/mL、癌胚抗原(CEA)<5 ng/mL、糖类抗原199(CA199)<35 U/mL、前列腺特异抗原(PSA)<4 ng/mL。
结论本方法测定结果准确、可靠且操作简便、快速,适宜于临床检测推广。
To evaluate the reliability of the quantitative determination of tumor markers using reagent kit based on the flowcytometry fluorescence immunoassay method.
MethodsThe precision,linearity, rate of carryover and interference-resistance of the kits were evaluated using the automated analyzer LuminexTM-100 as determination instrument,and the results were compared with a comparative determination using Bio-Ekon Serozyme Ⅰ system.
ResultsThe chemical character evaluation showed that the within-run and between-run coefficients of variation ( CV) were less than 10% and 14% respectively.The results demonstrated excellent linearity( r>0.99).The rates of carryover were generally acceptable(<0.5%). The assay had no significant interference by haemoglobin (Hb),bilirubin (Bil) and triglyceride (TG) ( P>0.05). The correlation between the evaluated kits with LuminexTM-100 and Bio-Ekon Serozyme Ⅰ system was excellent( r>0.975).The tumor markers of serum samples from 506 healthy subjects (24 years old to 84 years old) were determined,and the reference result was alpha fetoprotein (AFP)<15 ng/mL,carbohydrate antigen 125(CA125)<35 U/mL, carcinoembryonic antigen (CEA)<5 ng/mL,carbohydrate antigen 199(CA199)<35 U/mL and prostate specific antigen (PSA)<4 ng/mL.
ConclusionsThe quantitative assay is safe, precise, accurate and easy to operate, and it is worthy to extend for clinical application.
肿瘤标志物在肿瘤临床辅助诊断、治疗监测、追踪肿瘤的复发和转移方面具有重要的意义。临床应用中, 常常进行多项肿瘤标志物联检, 所使用的检测方法历经放射免疫、酶联免疫、固相芯片、化学发光等技术, 而我们这次方法学评价使用的是上海透景生命科技有限公司开发的多肿瘤标志物定量检测试剂盒(流式荧光免疫法)。该试剂盒基于Luminex液相芯片技术平台, 将相应肿瘤标志物单抗联接于不同微球上(微球种类可达100种), 即理论上最多可以同时检测100种肿瘤标志物, 需要检测何种标志物可根据临床需要自行组合。本研究中选取了甲胎蛋白(AFP)、糖类抗原125(CA125)、癌胚抗原(CEA)、糖类抗原199(CA199)、前列腺特异抗原(PSA)5项指标作为评价指标。
1. 仪器 LuminexTM-100多功能流式点阵分析仪、恒温箱和振荡器。
2. 多肿瘤标志物定量检测试剂盒(流式荧光免疫法) 评价试剂由上海透景生命科技有限公司提供。因为流式点阵检测内容可选, 我们所选取的检测指标为AFP、CA125、CEA 、CA199、PSA。试剂盒主要构成:标准系(定值, 批号为S080301、S090101、S090201, 6个浓度), 反应缓冲液(A液), 微球混悬液(B液, 分别交联相应肿瘤标志物单抗的5种微球混合溶液), 藻红蛋白(PE)标记混合抗体溶液(C液, PE标记的相应肿瘤标志物抗原的5种抗体混合溶液), 终止液(D液), AFP HOOK指示微球溶液(H液)。
3. 测定样本 北京大学医院门诊和病房肿瘤患者血清40例; 健康体检人员506名。静脉抽血4 mL于美国BD公司分离胶试管中, 3 000 r/min(离心半径为8 cm)离心10 min, 分离血清-20 ℃冷冻保存。
1. 操作方法 严格按照试剂盒的测定参数和操作规定进行设置和检测, 使用试剂盒携带的软件进行样本中相应肿瘤标志物浓度计算。
2. 评价方法 按照美国临床实验室标准化委员会(NCCLS)评价方案对试剂的精密度、线性、抗干扰性等进行评价, 并评价试剂的携带污染率、最低检测限和正常参考值范围。
采用SPSS 10.0统计软件及Excel2000进行配对t检验和回归分析。
按照NCCLS精密度评价方案[1], 因临床5项肿瘤标志物高值样本不易得到, 我们在临床血清样本中加入低、中、高值标准液, 作为分析血清样本。批内:选取低、中、高值样本各1份, 各连续测定20次。批间:选取低、中、高值样本各1份, 各连续测定10 d, 每天测定2次。结果显示低、中、高值样本的各项肿瘤标志物批内变异系数(CV)均< 10%, 批间CV均< 14%。见表1、2。
| 表1 批内精密度的测定结果 |
| 表2 批间精密度的测定结果 |
按NCCLS线性评价方案[2], 选低值和高值样本各1份, 低值样本为1号, 高值样本为5号, 二者3∶ 1混匀为2号, 等份混匀为3号, 1∶ 3混匀为4号, 2~4号样本的浓度按下式计算:样本浓度=(C1V1+C5V5)/(V1+V5)其中C为浓度, V为体积。5份样本各重复测定3次。结果显示各项肿瘤标志物线性良好, 各稀释度的检测结果与期望值之间密切相关(r均> 0.99)。r值分别为0.999 5、0.999 7、0.991 3、0.998 4、0.995 9, 回归方程分别为Y=1.043 1X+6.762 4、Y=0.958 2X-9.178 5、Y=0.999 3X-8.963 7、Y=0.944 5X-2.620 3、Y=0.943 3X+0.168 3。
按NCCLS干扰实验评价方案[3], 取高三酰甘油(TG, 10.08 mmol/L)、高血红蛋白(Hb, 121 g/L)和高胆红素(Bil, 220.6 μ mol/L)样本, 与各指标值进行比例稀释后, 每份样本测定2次。结果显示Hb、Bil、TG对测定结果无显著干扰(P均> 0.05)。
采用国际血液学标准化委员会制定的程序[4], 取1份高值样本连续测定3次, 再取1份低值样本连续测定3次, 携带污染率结果为[(L1-L3)/(H3-L1)]× 100%(L为低值样本, H为高值样本)。此5项指标的携带污染率分别为0.006%、0.035%、0.043%、0.008%、0.114%, 携带污染率均< 0.5%。
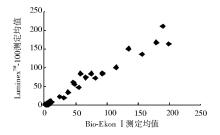
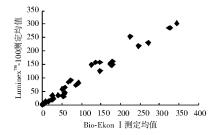
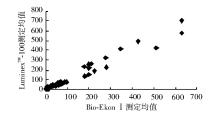
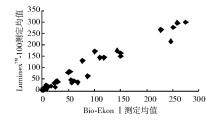
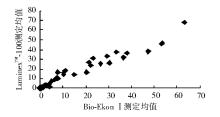
按NCCLS EP9-A方法比对方案[5]进行比对。随机选取临床低、中、高不同范围的血清样本50份, 用LumixneTM-100流式荧光仪及配套试剂和Bio-Ekon SerozymeⅠ 内分泌定量分析仪和配套试剂进行平行双份重复测定, 按1→ 10顺序进行测定, 再按相反顺序10→ 1重复测定, 以上步骤重复5 d(不连续), 进行相关性分析, 结果显示5项指标相关性良好(r> 0.975)。见表3和图1~5。
| 表3 LuminexTM-100流式荧光仪和Bio-EkonⅠ 内分泌定量分析仪测定结果比较 |
测定20个空白孔的荧光值, 计算其平均值(
北京大学健康体检人员506名, 其中男264名, 年龄26~80岁, 平均(57.25± 14.21)岁, 女242名, 年龄24~84岁, 平均(55.28± 13.20)岁。用流式荧光免疫法进行肿瘤标志物浓度测定, 因为数据的分布属偏态, 99%分布范围不能以
| 表5 各项肿瘤指标的正常参考值 |
肿瘤液相芯片是20世纪90年代中期发展起来的以美国Luminex公司的XMAP(flexible multi-analyte profiling)技术为基础的新型生物芯片技术平台。在其多功能流式点阵分析仪上, 荧光编码的微球可被微量液体传送系统排成单列, 通过2束激光, 一束判定微球的编码, 从而决定被测物质的种类; 另一束测定微球上PE的荧光强度, 由仪器自动转换成数字信号, 数字信号的高低即反映被测物质的含量。由于肿瘤标志物的产生受机体一些生物活性因子的影响, 多年来某些肿瘤标志物在应用中存在敏感性不高、特异性不强等问题, 国内外学者提出了多肿瘤标志物联合检测优于单一指标检测的观点, 肿瘤标志物蛋白芯片是基于多指标检测的思路, 发挥蛋白芯片的优势而建立的又一种肿瘤实验室检测技术[6]。基于Luminex流式芯片技术开发的肿瘤标志物定量检测试剂盒的基本实验原理是双抗体夹心法。抗5种不同肿瘤抗原的捕获单克隆抗体(一抗)共价交联在5种荧光编码的微球上, 混合后形成B液, 与血清中的样本(或校准品)反应后, 加入PE标记的抗不同肿瘤抗原的5种检测抗体(二抗)混合液(C液), 最终形成了微球-一抗-肿瘤标志物-二抗-PE的复合物。但因为反应体系中, 将固相载体改变为直径5.6 μ m的荧光微球, 整个反应都得以在液相中完成, 这使得反应更为充分。而利用不同的荧光编码微球, 单次实验就可以对多个指标同时进行检测, 与酶联免疫吸附试验(ELISA)相比, 简化了实验过程, 缩短了检测时间。另一方面, 因为每一个微球相当于1次ELISA, 对同一指标同时检测多个微球(通常为100个), 去掉离群值, 再取其中位数进行计算, 使得检测结果更为准确, 对样本进行定量检测的准确性能够得到较好的保证。
微球的质量控制很重要。大小、材质、颜色要严格均一, 确保微球上被活化的位点数目尽量一致、编码准确。整个实验过程涉及的环节很多, 使得系统很依赖于校验系统。从已有的结果看, 微球系统的敏感性、准确性高于传统ELISA和放射免疫法[7]。
基于Luminex流式芯片技术开发的肿瘤标志物检测试剂盒体现了该技术的优势。从实验来看, 检测速度快, 线性好, 数据准确、可靠, 对于脂血、胆红素血、溶血等抗干扰性强, 值得在临床上推广使用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|