作者简介:崔维韻,女,1968年生,硕士,副主任技师,主要从事细胞免疫研究。
在生命科学及生物学领域,以往多采用有机染料标记生物大分子和细胞,来研究蛋白质之间的相互作用以及对细胞功能的影响等。然而有机染料存在着诸多缺点限制了他的应用, 量子点(quantum dot,QDs)在10年前还鲜为人知,近年来其作为新型的生物标记物克服了有机染料的许多缺点,逐渐被人们认识并关注。作为半导体纳米晶体,他独特的光电特性为荧光探针的设计应用提供了空前的前景,极大地扩展了荧光成像在细胞与活体动物中的应用[ 1]。现对其进行简要综述。
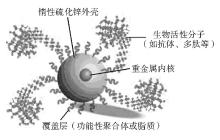
1. QDs的基本特性 QDs由重金属内核(如硒化镉、碲化镉)和惰性硫化锌外壳以及包被有特定的不同活性分子的专门的覆盖层组成。见 图1[ 2]。其作为一种无机荧光基团,能接受激发并产生荧光,可被从紫外至近红外范围的光所激发,具有宽的激发光谱和窄的发射光谱,并可被单一波长的光激发并发射多种波长的光。他是一个直径大约为5~8 nm (大约为200~10 000个原子)的球体,其尺寸越小,带隙能量就越大,辐射光子波长越往短波长方向偏移。其发射波长可通过选择他的适当尺寸来进行调节。另外,在同一个尺寸下选择不同的QDs材料同样也可以对他们进行波长调节。因此,在实际应用中可以使用多个QDs对细胞和生物分子进行荧光标记,并且可用同一波长的光来激发不同颗粒大小、不同种类的QDs,并采用单个激发光源实现同时探测,具有很高的敏感性和分辨率。同时光稳定性好,可用于长时间的生物荧光探测,不易淬灭,荧光寿命长。
当然,QDs也存在着一些缺陷,所以目前他们尚未具有完全取代有机荧光染料的能力。虽然目前QDs已经部分商用化了,但是与有机荧光染料相比,他的制作成本比较高,价格十分昂贵(大约为1万美元/g),并需大量的安全设备。QDs在活体内的惰性以及对活体的毒性还有待长期的验证。
2. QDs的水溶性修饰 合成后的QDs表面常包裹一层疏水的配体覆盖层。QDs的生物学应用要求对其表面进行亲水性修饰,处理方法通常有以下2种:(1)用双功能配位体(如巯基乙酸)取代疏水基团,其能连接QDs的表面,使羧基酸基团从QDs延伸,以大大增强其在水溶液和极性溶液中的溶解性;(2)在QDs有机配位体上,直接加上含有亲水基团的两性聚合体分子。QDs一旦具有水溶性,就能和核酸、蛋白质或小的生物分子很好的结合。QDs覆盖层的亲水性处理,同时为QDs提供了氨基、羧基、羟基等功能结合位点。
3. QDs的生物毒性 经修饰处理的QDs,虽然含有对细胞和组织有害的元素,但实验证实,并未产生生理伤害,并保持QDs的理化特性,可作为细胞示踪分子,用于细胞动态观察[ 3]。至少在一些细胞系统,QDs与自然配体的结合可很容易地进入细胞,并且不干扰细胞内的信号传导,无毒性[ 4, 5]。而近期有报道称不同理化性质的QDs可穿透完整的皮肤[ 6]。也有研究者指出QDs705在动物和人体内具有很长的生物学半衰期,这样会在肝、肾等器官形成长期积累,势必会对健康造成影响[ 7]。因此,对QDs用于活体内,需进行彻底、细致的安全评估[ 1]。
4. QDs的生物标记方式 目前有以下几种方式:(1)静电结合:即把活性基团连接在QDs上,同时用另一活性基团修饰生物大分子,利用2种活性基团的静电作用实现结合;(2)共价结合:对QDs表面进行亲水性修饰,使其附着亲羧基、氨基、巯基等的极性官能团,或采用聚丙烯酸、聚乙二醇等以共价结合的方式包被QDs;(3)利用连接反应进行结合:利用生物素、链霉亲和素、卵白素等包被QDs,使其获得活性基团。
1998年9月,Bruchez等[ 8]和Chan等[ 9]制备了水溶性的QDs,并设计了共轭或化学结合的连接方式,将QDs作为生物探针用于活细胞体系,从此有关QDs的报道不断出现。
1. 生物分子标记 (1)核酸标记:QDs可标记寡核苷酸探针,用于基因芯片或蛋白质芯片的检测,这种光谱编码技术为基因表达的研究、高通量筛选试验以及临床医学诊断等提供了可能。QDs技术同样作为一种新的基因分析方法用于低含量的点突变的分析中,该方法基于经表面处理的QDs与寡聚核苷酸结合,通过共聚焦荧光检测系统,检测QDs荧光,使其等位基因辨别选择性因子>10 5 [ 10]。Crut等[ 11]将DNA 分子两端通过杂化和连接作用序列特异地连接上生物素化和/或异羟基洋地黄毒苷元化的DNA 片段,这种修饰的DNA 在玻片上展开,可直观观察QDs的多色荧光。在合适的条件下,单个 DNA 的位置方向可通过单一的QDs荧光信号被推断出,因此采用多色的QDs进行两末端标记检测单个DNA分子,可避免荧光DNA黏合剂诱导产生的DNA分子的裂解,而干扰DNA与蛋白之间的相互作用。一个细胞群中,用RNA干扰以鉴定基因型/表现型相互关系,一个关键问题是基因沉默的统一性。转染率的变化、传递过程中引起的细胞毒性和高小干扰核糖核酸(SiRNA)时的“脱靶”效应可混淆其功能研究,Chen等[ 12]将未变性的SiRNA与QDs作为多色生物探针相结合,以监测SiRNA传递,该方法还可扩展到多种基因敲除的研究中。Lagerholm等[ 13]运用QDs的荧光间歇现象即“眨眼”的特点检测了122个首尾相连的碱基对组成的DNA片段的长度;(2)免疫标记:传统意义上荧光免疫技术存在着或多或少的缺憾,近年来QDs的应用,使之有了新的发展。有学者将QDs经巯基琥珀酸处理后与抗体连接,作为高通量蛋白芯片的荧光标记物,共价结合于芯片上的特异性抗原,运用激光共聚焦扫描仪对标记抗体-抗原复合物的荧光信号进行检测[ 14]。Goldman等[ 15]将QDs与已知抗体相连,形成探针,采用亲和色谱技术纯化这种探针,并用于酶联免疫吸附试验(ELISA)对葡萄球菌肠毒素和2,4,6-三硝基甲苯的测定,敏感性很高。他们进一步将QDs经亲和素修饰,并将相应的抗体生物素化,提高QDs与抗体结合的效率,用于葡萄球菌肠毒素、霍乱毒素等毒素的检测。另外QDs还可用于一个样本中不同组分的同时测定。他们用夹层免疫分析的方法同时检测霍乱毒素、蓖麻毒素、志贺样毒素1、葡萄球菌肠毒素B等4种毒素的混合物。经试验证明,这种QDs-抗体混合物不仅可以同时检测出毒素成分,还可以进行定量分析;(3)细菌和细胞标记:Kloepfer等[ 16]首次采用QDs标记微生物,即利用细菌和真菌表面的受体如糖蛋白作为与QDs共轭的目标连接分子,对微生物进行检测。Anikeeva等[ 17]通过QDs标记肽-主要组织相容性复合物(MHC)生物感受器,研究揭示了细胞毒性淋巴细胞(cytotoxic T lymphocytes, CTL) 在自身与病毒抗原之间强烈的CD8依赖的协同作用。Zhu等[ 18]通过QDs与MHC共轭连接,研究了人合胞体病毒(HSV-2)复活的急性、消退、痊愈阶段,其HSV-2特异的CD8+ T 细胞在人生殖表皮细胞组织活检中的定位,指出人 HSV-2复活的临床过程和频率受病毒特异的CD8+ T 细胞的影响,在疱疹损伤消除后,这些细胞持续存在于外周黏膜和生殖器皮肤上。Nechyporuk-Zloy等[ 19]用双色QDs标记检测单个细胞膜钾离子通道,并预示QDs可用于细胞膜上其他离子通道的单一分子水平上的标记检测。Crane等[ 20]发现细胞膜上QDs标记的水通道1(AQP1)的大范围的异常渗透。Haggie等[ 21]通过QDs标记囊性纤维化跨膜转导调节因子(CFTR),揭示CFTR在细胞膜上的制动作用,并且为C-末端经雌二醇结合蛋白/埃兹蛋白(EBP50/ezrin)连接肌动蛋白骨架对其固定作用所起的重要意义提供了直接的依据。
2. 细胞标记成像与示踪 Chan等[ 9]在1998年对QDs技术标记细胞进行了具有开创性的研究。他们用巯基乙酸修饰的QDs标记转铁蛋白,再与Hela细胞共同孵育,在受体介导下(即QDs标记的转铁蛋白与细胞表面转铁蛋白受体相结合)发生细胞内吞作用后,可以在Hela细胞中观察到QDs。这不仅证明经QDs标记的转铁蛋白仍然具有生物活性,而且也证明了QDs的大小能够自然地通过吞噬作用进入细胞。Wu等[ 22]首先将QDs与抗体和链霉亲和素结合,再与抗人类表皮生长因子受体2(Her2)抗体和核抗原抗体结合,并通过其与相应的细胞表面的Her2和核抗原的准确结合而标记细胞,并且不论是固定细胞、活细胞还是石蜡组织切片,均能成功标记Her2。Jaiswal等[ 3]用2种方法(即胞吞QDs、连接QDs的抗体与细胞表面相应蛋白结合)使硒化镉-硫化锌(CdSe-ZnS)QDs标记活细胞,评价QDs-抗生物素蛋白链霉素的特异性,在同一细胞分别用QDs630-抗生物素蛋白链霉素标记细胞核的核抗原,用QDs535-抗生物素蛋白链霉素标记胞质的微管,在同一波长激发下,可以清楚区分出2种标记的颜色和部位,证明QDs-抗生物素蛋白链霉素对目标靶分子具有高度特异性,并可利用不同发光颜色QDs来标记不同种类的蛋白、细胞以及同一细胞的不同组分。Lin等[ 23]用QDs标记小鼠胚胎干细胞,经皮下注入裸鼠中成像,显示出QDs对细胞活力、增殖与分化能力无副作用。QDs技术同样可用于神经元和神经胶质,Dahan等[ 24]采用抗体结合QDs示踪经培养的初级脊索神经元。Vu 等[ 25]将标记了QDs的神经生长因子(βNGF)用于增强嗜铬细胞瘤细胞(PC12)向神经细胞样转化的培养。Fan等[ 26]和Howarth等[ 27]进一步研究了QDs对培养的海马细胞的标记。有关神经系统方面的研究仍在进行中[ 28, 29]。
3. 生物体内标记成像与示踪 QDs在生物标记应用的另一个重要部分是他不仅可以用于细胞成像,还可以用于生物活体成像,即对动物体内的靶组织或细胞进行标记,其原理是:用于动物体内的QDs探针上的功能分子有不同的肽链,利用不同的肽链分子识别不同的靶细胞。2003年,Larson等[ 30]将水溶性的CdSe-ZnS QDs经尾静脉注射给小鼠,通过双光子扫描显微镜观察到皮下毛细血管高清晰度的三维影像及640次/min的毛细血管搏动,引起轰动。Dubertret等[ 31]将QDs技术用于非洲蟾蜍早期胚胎发育的体内成像,他们将QDs包入磷脂嵌段共聚物微粒中,并通过化学修饰,形成QDs-DNA-微粒,将这些微胶粒注入胚胎卵裂球8个细胞中的1个,跟踪观察了胚胎发育的几个阶段。Gao等[ 32]采用前列腺特异性膜抗原(PSMA)的抗体与QDs连接,皮下注入小鼠体内,可清楚地观察到肿瘤的大小和位置,可以对含有10~100个肿瘤细胞的小鼠体内进行超敏感检测。
以上所举的只是QDs的一些基本应用,随着研究的不断深入,人们对QDs的性质将有更深刻的认识,通过QDs制备工艺的不断完善,不断克服其不足之处,我们相信,QDs在生物标记中的应用可以为大量多项实验和诊断学带来新的发展手段,也将会成为生物医学标记应用中的一项颇具前景的新技术。正如Shimon Weiss所说:“我们正观赏着关于QDs生物学应用的壮观场景”。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|