通讯作者:蒋燕群,联系电话:021-64369181-8848。
作者简介:侯伟伟,女,1983年生,硕士,主要从事细菌耐药性研究。
对革兰阴性菌产AmpC酶的检测方法进行评价,并寻找一种适合临床常规应用的AmpC酶检测方法。
方法对39株耐头孢西丁的革兰阴性菌同时进行改良Hodge试验、三维试验、氯唑西林(CLO)双纸片协同试验和ampC基因聚合酶链反应(PCR)检测,比较4种方法的结果。
结果39株革兰阴性杆菌中,改良Hodge试验、三维试验和CLO双纸片协同试验检出产AmpC酶的阳性率分别为38.5%、43.6%和28.2%,3种方法AmpC酶检出率的差异无统计学意义(
改良Hodge试验可作为一种操作快速、简便的筛选试验检测革兰阴性菌产AmpC酶的情况,而CLO双纸片协同试验可作为一种操作简便的排除产AmpC酶试验应用于实验室,但在准确性上低于改良Hodge试验。
To evaluate methods for detecting AmpC beta-lactamase produced by Gram-negative bacillus and find a convenient and suitable method for clinical laboratories.
MethodsModified Hodge test , three-dimensional test, cloxacillin (CLO) double-disk synergy test and polymerase chain reaction (PCR) were performed in the 39 cefoxitin-resistant strains of Gram-negative bacillus, and then their results were compared.
ResultsFrom the 39 strains of Gram-negative bacillus, the AmpC positive rates of modified Hodge test, three-dimensional test and CLO double-disk synergy test were 38.5%, 43.6% and 28.2%,respectively. The percentage of detection of AmpC had no significant difference among three phenotype screening tests(
Modified Hodge test is a convenient method to detect AmpC enzyme produced by Gram-negative bacillus,and CLO double-disk synergy test is easy to use in clinical laboratories to eliminate a possibility of AmpC beta-lactamases production, but modified Hodge test is better than CLO double-disk synergy test in the accuracy.
近年来,随着β-内酰胺类抗菌药物的大量应用,由β-内酰胺酶介导的革兰阴性杆菌耐药给临床抗感染治疗带来了严重的问题,其中AmpCβ-内酰胺酶引起的细菌耐药日益增多并越来越被人们所关注。但关于AmpC酶的检测方法,美国临床实验室标准化研究所(CLSI)尚无统一标准,所以仍缺乏适用于临床实验室快速检测AmpC酶的方法。目前,国内外已报道了多种检测AmpC酶的方法,至今仍未建立起一种筛选和发现AmpC酶的标准的表型检测方法[ 1]。本研究对改良Hodge试验、三维试验、氯唑西林(CLO)双纸片协同试验3种检测法的可行性进行探讨,以找出一种适用于临床的快速、简便、可靠的检测 AmpC酶的方法。
1. 菌株 2006年1月至2008年9月血标本中分离得到的革兰阴性杆菌181株,包括大肠埃希菌67株,肺炎克雷伯菌34株,铜绿假单胞菌23株,鲍曼不动杆菌13株,阴沟肠杆菌7株,弗劳地枸橼酸杆菌和产气肠杆菌各3株,其他细菌31株,无重复株。以大肠埃希菌(ATCC 25922)作为AmpC酶阴性对照,以去阻遏持续高产AmpC酶的阴沟肠杆菌(029M)作为 AmpC酶阳性对照。
2. 试剂 药敏纸片均购自Oxoid公司,包括头孢西丁(FOX)、头孢他啶(CAZ)、头孢噻肟(CTX)、头孢吡肟(FEP)、亚胺培南(IPM)、CLO等。聚合酶链反应(PCR)扩增试剂盒购于上海生工公司,引物也由上海生工公司合成。
3. 仪器 PCR基因扩增仪(Eppendorf),WALKAWAY-40微生物鉴定药敏系统(Dada-Bering,Sacramento,美国)。
1. AmpC酶初筛试验 采用纸片扩散法对临床革兰阴性菌进行AmpC酶的表型筛选,凡纸片扩散法FOX抑菌圈直径≤18 mm,即认为是可能产AmpC酶菌株[ 2]。在181株血标本来源的细菌中,将初筛阳性的39株作为本实验所选用的菌株。
2. 酶粗提物的制备 取过夜培养的纯分离菌落接种到5 mL LB肉汤中,35 ℃孵箱培养4 h,2 000 r/min(离心半径为9.2 cm)离心20 min,弃上清,将沉淀物反复冻融5~7次,12 000 r/min(离心半径为9.2 cm)离心20 min,取上清作为酶粗提物。
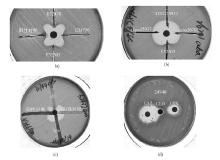
3. 三维试验 参照参考文献[3]方法进行,在水解酪蛋白胨(MH)琼脂平板上均匀涂布0.5麦氏单位的大肠埃希菌(ATCC 25922)菌液,将FOX纸片贴于平板中央,用无菌刀片沿FOX纸片边缘5 mm处放射状切一裂缝,裂缝里加入25 μL酶粗提物,35 ℃孵箱培养16~18 h后,观察抑菌圈的形状,如果平皿上出现一个沿槽周围生长指向FOX纸片的矢状菌苔,即为三维试验阳性,见 图1。
4. 改良Hodge试验 将0.5麦氏单位大肠埃希菌(ATCC 25922)均匀涂布于MH琼脂平板,待表面干燥后,在平板中央贴一FOX纸片,用环挑取2~3个过夜培养的待检菌落,并稍用力沿纸片边缘划向平板边缘,置35 ℃孵箱培养18 h,观察待检菌周围FOX抑菌圈的变化,如果抑菌圈变化≥2 mm,则提示产AmpC酶阳性[ 4],见 图1。
5. CLO双纸片协同试验 将0.5麦氏单位的待检菌菌液均匀涂布MH琼脂平板,待表面干燥后,CLO纸片贴于平板中央,在距离CLO纸片16和18 mm处贴上CAZ和CTX,35 ℃孵箱培养18~24 h,CLO与任何一个纸片有协同则判定为产AmpC酶的菌株,见 图1。
6. 多重PCR 参照文献合成具有群特异性的6对引物[ 5],对初筛试验阳性的39株菌株进行多重PCR检测。
7. 测序 PCR产物送上海生工公司测序,进行 Blast比对。
血培养标本分离出的181株病原菌中,初筛试验阳性39株,阳性率为21.5%。其中鲍曼不动杆菌13株,阳性率100%(13/13),大肠埃希菌9株,阳性率为13.4%(9/67),肺炎克雷伯菌8株,阳性率为23.5%(8/34),阴沟肠杆菌7株,阳性率为100%(7/7),弗劳地枸橼酸杆菌和产气肠杆菌各1株,阳性率均为33.3%(1/3)。
采用 χ2检验对39株革兰阴性菌检测结果进行分析,三维试验、改良Hodge试验和CLO双纸片协同试验的检出率(分别为43.6%、38.5%和28.2%)之间差异无统计学意义( P>0.05)。与PCR比较,三维试验敏感性、特异性和符合率分别为75%、78%、76.9%,改良Hodge试验分别为75%、87%、82.1%,CLO双纸片协同试验分别为50%、87%、71.8%。
39株临床菌株中,16株ampC基因扩增阳性。其中6株阴沟肠杆菌,6株鲍曼不动杆菌,3株肺炎克雷伯菌,1株弗劳地枸橼酸杆菌。对16株阳性菌的ampC基因进行双向测序,ampC测序结果进行Blast比对,结果显示6株阴沟肠杆菌为EBC型AmpC酶,3株肺炎克雷伯菌为DHA-1型质粒AmpC酶,1株弗劳地枸橼酸杆菌为CMY-2型质粒AmpC酶,16株阳性菌ampC基因的核苷酸序列与其相应的ampC的同源性均高达98%~100%。
AmpC β-内酰胺酶是由ampC基因编码的具有丝氨酸活性中心的头孢菌素酶,主要是由肠杆菌属、不动杆菌属、枸橼酸杆菌属、摩根摩根菌属等革兰阴性杆菌产生。近年来,由于β-内酰胺类抗菌药物的过度使用,使得β-内酰胺酶介导的耐药情况越来越严重,最终给临床抗菌药物的选择和治疗带来了困难。其中AmpC酶是目前被微生物学家关注的β-内酰胺酶之一。快速检测持续高产 AmpC酶对临床合理用药起到至关重要的作用。所以,我们必须采取一种合适的方法筛选临床常见革兰阴性菌中的AmpC酶。
本研究结果显示,23株铜绿假单胞菌的初筛试验均为阴性,说明我院的铜绿假单胞菌耐药情况比较少见。鲍曼不动杆菌耐FOX率高达100%,但基因检测只有6株为ampC阳性,9株初筛试验阳性的大肠埃希菌基因检测均为阴性,所以FOX初筛试验用于检测AmpC酶的假阳性较高,可能由于膜孔蛋白缺失的菌株或产ESBLs的菌株也表现为对FOX的耐药[ 6],因此他只能作为一种初步的AmpC酶筛选法,仍需其他表型筛选试验加以确定。
AmpC酶的表型筛选结果显示,与其他表型筛选法比较而言,改良Hodge试验与PCR的符合率最高,敏感性和特异性也占了一定的优势。另外在39株革兰阴性菌中,26株肠杆菌科细菌和13株鲍曼不动杆菌改良Hodge试验筛选AmpC酶的敏感性、符合率相差比较大,肠杆菌科细菌敏感性和符合率分别为100%和92.3%,而鲍曼不动杆菌敏感性和符合率为33%和61.5%,所以改良Hodge试验是否适用于鲍曼不动杆菌有待以后的研究证实。
从表型试验的统计结果可见,在8株双纸片协同试验阴性、三维试验阳性的菌株中有5株PCR阳性,而在5株改良Hodge试验阴性、三维试验阳性的菌株中有2株PCR阳性,这极有可能是纸片协同试验漏检所致。但在实验中,我们还发现有纸片协同试验阳性、三维试验阴性1株,及改良Hodge试验阳性、三维试验阴性3株,PCR阳性,这很可能是在三维试验操作过程中,酶冻融不彻底,使释放的酶量减少或种种原因造成酶丢失或失活所致。从而可知,不管是纸片协同试验还是三维试验均存在一定的假阳性或假阴性的情况。2002年Yong等[ 4]就提出将改良Hodge试验作为检测AmpC酶的一种方法,但其后仅把他作为一种检测产质粒AmpC酶的方法。2008年,发现染色体介导的AmpC酶改良Hodge试验也可以是阳性[ 7]。在本实验中,我们也发现改良Hodge试验的总符合率和敏感性高于双纸片协同试验,这很可能是因为CLO双纸片协同试验扩散性差、纸片距离或药敏纸片较少的因素使酶检出率较低。
为了解初筛试验阳性菌株中ampC基因的情况,我们对16株阳性株的ampC基因进行了扩增和测序分析,其中有2株细菌3种表型筛选方法均为阴性,这也就是说PCR扩增阳性的菌株并不一定会高产AmpC酶,中间还受到转录和表达水平的影响。所以PCR只能是基因水平检测AmpC酶的金标准。
综上所述,在AmpC酶的检测方法中,三维试验和PCR是比较公认的方法,但两者都存在一个共同的缺点就是操作比较繁琐、费时,所以很难应用于临床来满足快速有效检测AmpC酶的要求。而双纸片协同试验和改良Hodge试验操作简便、快速、省时,但研究结果显示,CLO双纸片协同试验的敏感性和符合率比较低,故而对其结果的可靠性有待怀疑。改良Hodge试验检测 AmpC酶快速、简便,且符合率也高于以往公认的三维试验,因此可以作为常规的方法广泛应用于临床AmpC酶的检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|