通讯作者:倪语星,联系电话:021-64370045-600633。
作者简介:韩立中,男,1969年生,博士,副主任技师,主要从事细菌耐药机制及医院感染控制研究。
评估新的产色培养基ChromID ESBL在检测产超广谱β-内酰胺酶(ESBLs)肠杆菌科细菌中的可靠性。
方法用2组肠杆菌科细菌进行评估,一组为285株上海地区检出的临床分离株,这些菌株已用美国临床实验室标准化研究所(CLSI)推荐的确证试验确认了是否产ESBLs,另一组28株产ESBLs肠杆菌科细菌,在以前的研究工作中已确认了这些菌株的产酶特性和ESBLs基因型别。
结果ChromID ESBL能有效地检测产ESBLs的肠杆菌科细菌。
结论ChromID ESBL是一种可靠的产ESBLs肠杆菌科细菌的筛选培养基。
To evaluate the reliability of a new selective chromogenic agar medium, ChromID ESBL, for detection of extended-spectrum beta-lactamases (ESBLs)-producing
Two arrays of isolates were used to evaluate the reliability of ChromID ESBL. One array contained 285 clinical isolates in which the ESBLs-producing feature was screened by confirmatory tests recommended by Clinical and Laboratory Standards Institute (CLSI). The other array contained 28 enterobacterial isolates with their ESBLs gene and producing enzyme feature being confirmed previously.
ResultsBoth groups of ESBLs-producing
ChromID ESBL is a reliable culture medium for screening and identification of ESBLs-producing
近些年来,产超广谱内酰胺酶肠杆菌科细菌在医院获得性感染和社区获得性感染中的分离率升高已引起人们广泛的注意。为防止这类细菌暴发和流行,需建立快速、准确和方便易行的耐药菌表型筛选方法,对感染高危人群进行定期的流行病学调查[ 1]。到目前为止,已推出过数种超广谱β-内酰胺酶(ESBLs)的筛选平板,即添加不同浓度头孢噻肟和/或头孢他啶的麦康凯平板等[ 2],由于上述平板检测的是对三代头孢菌素耐药的肠杆菌科细菌,并非特异性地检测产ESBLs细菌。最近开发出一种新型的含有显色酶的筛选平板用于产ESBLs肠杆菌科细菌的筛查。本研究以2组菌株评估该平板对产ESBLs肠杆菌科细菌的筛选效果。
1. 标准菌株 包括大肠埃希菌(ATCC 25923)和肺炎克雷伯菌(ATCC 700603,携带SHV-18型ESBLs)。
2. 实验菌株 第1组细菌为上海瑞金医院和上海仁济医院2008年3至10月临床分离的285株肠杆菌科细菌,其中大肠埃希菌224株、肺炎克雷伯菌53株、奇异变形杆菌8株,这些菌株均用美国临床实验室标准化研究所(CLSI)推荐的ESBLs确认试验判读菌株是否产酶。第2组细菌为上海地区历年来分离到的,并在以前的研究工作中进行过产酶特性研究的28株肠杆菌科细菌,这些菌株包括大肠埃希菌8株、肺炎克雷伯菌12株、阴沟肠杆菌8株[ 3~ 5]。以上菌株均接种在ChromID ESBL显色平板上,了解这种平板对本地区流行的不同产酶菌株的筛选效果。
3. 培养基 ChromID ESBL(法国生物梅里埃公司产品,商品号43481),水解酪蛋白胨(MH)平板,血平板。药敏纸片头孢他啶(30 μg)、头孢噻肟(30 μg)、头孢他啶-克拉维酸(30 μg/10 μg)、头孢噻肟-克拉维酸(30 μg/10 μg)为BD公司产品。
1. ESBLs药敏纸片确证试验 按照CLSI的纸片扩散试验方法和条件在MH平板上进行头孢他啶(30 μg)、头孢噻肟(30 μg)、头孢他啶-克拉维酸(30 μg/10 μg)、头孢噻肟-克拉维酸(30 μg/10 μg)的药物敏感试验,并记录抑菌圈直径,按照2008年CLSI M100-S18标准判读结果,以加入克拉维酸纸片比相应不加的纸片抑菌圈直径>5 mm判断为产ESBLs[ 6]。
2. ChromID ESBL平板筛选试验 将血平板上过夜培养的细菌直接接种于显色平板上,35 ℃过夜培养,根据颜色判读试验结果。产ESBLs大肠埃希菌显粉红色或酒红色,而克雷伯菌属、肠杆菌属、沙雷菌属和枸橼酸菌属产ESBLs菌株在平板上显绿色、褐色或蓝色菌落,变形杆菌属、普罗威登斯菌属和摩根菌属的细菌产ESBLs的菌株在平板上显深灰或浅灰颜色。
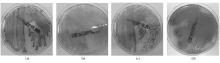
纸片确证试验大肠埃希菌中产ESBLs 145株,不产ESBLs 79株,肺炎克雷伯菌中产ESBLs 26株,不产ESBLs 27株,奇异变形杆菌中产ESBLs 3株,不产ESBLs 5株,其产酶特性及显色平板上生长情况见 表1。这些菌株接种ChromID ESBL,过夜培养后,产ESBLs菌株均可在平板上生长,而非产ESBL菌株均不能生长。在产ESBLs大肠埃希菌中,122株菌产红色菌落,另有23株菌产白色菌落,产白色菌落的大肠埃希菌占产ESBLs菌株的16%(23/145),其中来自瑞金医院的菌株中产白色菌落的菌株占该院产ESBLs大肠埃希菌的22%(12/54),而仁济医院分离的菌株占12%(11/91)。产ESBLs肺炎克雷伯菌菌株产绿色菌落,而奇异变形杆菌则产深灰或浅灰色菌落,见 图1。
| 表1 临床分离的285株肠杆菌科细菌2种方法筛选结果 |
在上世纪80年代,三代头孢菌素应用于临床治疗后不久,欧洲就分离到产ESBLs的肠杆菌科细菌,随后这类耐药菌在美国也开始出现,现在这个耐药问题已成为一个世界性的难题。为了有效控制产ESBLs细菌的流行播散,多种表型筛选方法被建立,如CLSI推荐的纸片筛选试验和确证试验等[ 6, 7]。但这些方法需要首先获得纯培养的菌株,然后才能进行ESBLs的表型检测。为了快速筛选产ESBLs的菌株,人们尝试建立从标本中直接筛选产ESBLs的菌株,如添加头孢噻肟的Drigalski琼脂、添加头孢他啶的麦康凯琼脂及添加了头孢他啶、万古霉素和两性霉素B的营养琼脂等,但这些筛选一般均为实验室自制的培养基,需要新鲜配置,不能很好满足临床的实际需要[ 8]。最近人们开始在显色平板的基础上建立一些特殊耐药细菌的筛选平板,如耐甲氧西林金黄色葡萄球菌显色筛选平板[ 9]及本研究所评估的ESBLs筛选平板等。
ChromID ESBL含有多种营养成分和多种抑制革兰阳性菌和真菌的抗菌药物,其中头孢泊肟是用来筛选产ESBLs的菌株,有资料显示对已发现的所有类型的ESBLs,头孢泊肟是最好的一种底物[ 10, 11]。另外该平板还含有2种产色底物和1种天然底物,以直接鉴定产ESBLs的肠杆菌科细菌。由于大部分的菌株产β-葡萄糖醛酸苷酶,因此大肠埃希菌在该平板上显粉红色或酒红色,而不产β-葡萄糖醛酸苷酶的菌株为白色菌落。而克雷伯菌属、肠杆菌属、沙雷菌属和枸橼酸菌属细菌由于产β-葡萄糖苷酶,在平板上显绿色、蓝色或棕绿色菌落。变形杆菌属、普罗威登斯菌属和摩根菌属细菌产脱氨基酶,这些菌株在ChromID ESBL平板上显浅灰色或深灰色。因此将标本直接接种于ChromID ESBL平板上可达到筛选产ESBLs菌株和辅助鉴定的双重作用。本研究中使用该平板对上海地区分离的肠杆菌科细菌进行了产ESBLs菌株的筛选,结果与CLSI推荐的纸片确证试验非常符合,取得了满意的效果。在研究中我们发现,23株产ESBLs大肠埃希菌菌株为不产β-葡萄糖醛酸苷酶的菌株,在ChromID ESBL平板上为白色菌落(其中瑞金医院为12株,仁济医院为11株),对这部分菌株应加做吲哚试验等鉴别试验,以正确鉴定大肠埃希菌。
近几年来,针对我国分离的革兰阴性杆菌所产ESBLs的基因型别、流行现状及检测方法均进行了较多的研究工作,研究表明CTX-M型各组及PER、VEB等型别为我国各地区分离的肠杆菌科细菌产生的主要ESBLs型别。在本研究中我们选取了其中的28株肠杆菌科细菌,通过纸片双抑制剂平行抑制试验及聚合酶链反应(PCR)等分子生物学方法已基本确认这些菌株的产酶表型和基因型,这些菌株为单纯产ESBLs或同时产AmpC酶菌株,其携带的主要ESBLs基因包括各种CTX-M型、PER和VEB等[ 3~ 5]。这些菌株可一定程度代表本地区常见的ESBLs基因。试验结果表明ChromID ESBL可有效地将这些菌株筛选出来。但应该注意的是本研究的目的在于评估该显色平板对上海地区产ESBLs流行克隆的筛选效果,因此采用的标本为纯培养的菌株,不是临床标本,但这也造成了本研究的局限性,ChromID ESBL的开发目的是为了从临床标本中直接筛选产ESBLs菌株,而不是对纯菌株进行分析。ChromID ESBL在临床的实际应用中,我们发现将粪便标本接种到显色平板上,肠道标本中的一些细菌,如肠球菌,也可在该平板上生长,并形成产色的菌落,识别这些菌落需要一定的经验和辅助试验。
通过以上研究表明,ChromID ESBL可应用于临床标本中产ESBLs肠杆菌科细菌的筛选。该平板的应用可缩短产ESBLs菌株的筛选时间,为临床抗感染治疗和医院感染控制提供帮助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|