通讯作者:庄俊华,联系电话:020-81887233-32908。
作者简介:徐建华,男,1976年生,硕士,主管技师,主要从事临床生化与分子生物学研究。
验证罗氏 Modular全自动生化分析仪酶学指标丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)分析性能。
方法根据美国临床实验室标准化研究所(CLSI)系列文件(EP5-A2、EP15-A2、EP6-A2、EP7-A2、C28-A2)和其他相关文献的实验方案,对罗氏 Modular全自动生化分析仪检测ALT、AST的精密度、准确度、线性、临床可报告范围、干扰和生物参考区间6大性能进行验证,并与厂商声明的性能或公认的质量标准进行比较。
结果精密度均符合罗氏性能标准;对卫生部5份室间质控品检测结果与靶值的相对偏倚(
罗氏 Modular 生化分析仪ALT、AST检测的主要分析性能符合质量目标要求,CLSI实验评价方案具有可操作性和实用性。
To validate the analytic characteristic of alanine aminotransferase(ALT)and aspartate aminotransferase(AST)measurement by Roche Modular automatic biochemical analyzer.
MethodsThe precision, accuracy, linearity, clinical reportable range , interference and biotic reference interval of ALT and AST were validated according to Clinical and Laboratory Standards Institute (CLSI) documents (EP5-A2, EP15-A2, EP6-A2, EP7-A2 and C28-A2) and other experimental procedures. The results were compared with manufacturer's claims and acceptable quality standards.
ResultsThe precisions were in line with the Roche performance standard. The system error (
The main analytic characteristic of ALT and AST measurement by Roche biochemical autoanalyzers is consistent with acceptable quality standards, and the experimental evaluation project of CLSI shows maneuverability and practicability.
医学实验室认可是目前检验医学界讨论和关注的热点[ 1, 2]。 《医学实验室质量和能力的专用要求》(ISO 15189)和美国病理家学会(CAP)要求参加其认可的实验室,在开展某一检测项目前,需提供并保留相关的方法学验证实验数据。但如何合理选择、系统设计定量检验项目方法学性能验证方案,检测系统的分析性能达到什么样的标准才能满足临床要求,国内报道甚少,是一个急需解决的现实问题。本实验室参考有关文献并结合实际工作,探讨了全自动生化分析仪定量项目方法学性能的验证方案,并顺利通过了ISO 15189实验室认可。现以罗氏Modular 全自动生化分析仪酶动力学法测定丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)为例报道,供同行参考。
1. 仪器与试剂 罗氏 Modular全自动生化分析仪;罗氏原装ALT、AST试剂(批号分别为68794101,68898601)、校准品cfas(批号17363201)、低值质控品(PNU:ALT 44 U/L, AST 43 U/L,批号17646901)、高值质控品 (PPU:ALT 124 U/L, AST 137 U/L, 批号17628701);Sysmex A-PLUS干扰试剂盒 (批号ZS6004)。
2. 样本 来源于广东省中医院就诊患者或正常体检者,样本要求为新鲜血清,无溶血、黄疸、脂血。
1. 精密度验证实验 参考美国临床实验室标准化研究所(CLSI)EP5-A2[ 3]文件,选择PNU和 PPU 2个水平的质控品,连续检测 20 d, 每天2批,每批重复测定2次。进行批内精密度和室内精密度性能验证。
2. 准确度验证实验 参考CLSI EP15-A2文件[ 4]进行。 (1)对卫生部临床检验中心2007 年6月发放的5个不同批号室间质控品进行检测,计算检测值和“靶值”的相对偏倚( SE%);(2)2007年连续6个月每月室内质控结果的均值与罗氏全球质控系统(QCS)质评结果的“靶值” 比较,计算相对 SE%;(3)临床可接受水平: SE%≤1/2 CLIA’88允许总误差( TEa), 即 SE%≤10%为可接受。
3. 线性实验 参考CLSI EP6-A2文件[ 5],设定实验室的重复性和线性的 TEa范围均为5%,按比例配制成9个系列浓度样本,每个样本重复检测3次。
4. 临床可报告范围(CRR)验证实验 CRR为患者样本经稀释、浓缩或其他处理后,向临床所能报告的结果范围。首先进行稀释回收实验,稀释回收率=(实测值/预期值)×100%。选择高浓度的样本3份(ALT: 1 202、1 427、2 399 U/L, AST: 935、1 041、2 825 U/L),用0.9%NaCl分别作5、10、20、50、100、200倍稀释。参考仪器说明书,回收率在90%~110%结果为可接受。结合分析灵敏度、最大稀释度确定临床可报告范围。
5. 干扰分析试验 参考CLSI EP7-A2文件[ 6]进行。(1)配对差异实验: ①依据EP7-A2推荐的分析物浓度,ALT、AST分别选择约80和400 U/L的新鲜血清作为基础样本,并重复测试10次,得到均值(
6. 生物参考区间验证实验 参考CLSI C28-A2文件[ 7]。本实验室ALT、AST直接转移《全国临床检验操作规程》(第3版)提供的参考区间。分别用20个参考值数据和60个参考值数据进行验证。检测结果首先利用文件提供的“1/3”规则进行离群值检验,然后按照C28-A2判断标准,验证转移的ALT、AST参考区间是否符合临床要求。
根据EP5-A2提供的统计方法进行分析后显示, χ2 值均低于相应自由度( R)95% CI的上限,见 表1,说明检测的批内和室内精密度与罗氏仪器说明书提供的精密度性能基本一致,差异无统计学意义。
| 表1 批内和室内精密度性能验证结果(U/L) |
5个不同批号室间质控品的检测结果与卫生部“靶值”的相对 SE%在-3.94% ~-9.09%之间。2007年1~6月份每月室内质控结果的均值与QCS的“靶值”的相对 SE%在-3.70%~5.85%之间,均在可接受范围以内。
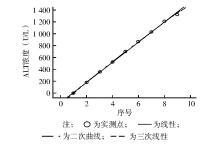
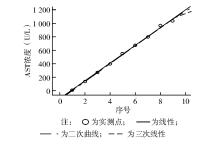
ALT和AST的低(L)值、高(H)值分别为4、4 U/L和1 332、1 031 U/L,经计算得ALT、AST的重复检测集合分差( SDr)分别为0.53%、0.58%,均未超过5%的设定 TEa范围,检测结果可用于线性评价。多项式回归统计结果显示, b2、 b3与0比较差异均无统计学意义( P>0.05),ALT、AST为一次线性,线性方程分别为 Y=168.15 X-148.155( P<0.05), Y=131.989 X -124.798( P<0.05),线性范围分别为4~1 332、4~1 031 U/L。线性回归图,见 图1和 图2。
当稀释度为1∶200时,ALT有2份样本的回收率(83.19%、84.09%)未在90%~110%范围,当浓度达到2 399U/L时回收率才落在可接受范围内;而AST各稀释度回收率均在90%~110%范围,结果见 表2。
| 表2 ALT、AST稀释回收实验结果 |
本实验设定基础样本均值的10%为 dmax,查 dmax/ s表可得 n=3。配对差异实验的结果显示FBil 0.2 g/L、CBil 0.4 g/L、乳糜835浊度对2个项目均无明显干扰。2.41 g/L Hb对ALT高、低2个分析物浓度检测无干扰,对AST检测却有明显的正干扰(dobs> dc),具体干扰效应,见 表3。 由 图3和 图4可知Hb≤6.025 g/L对AST高、低2个分析物浓度水平的干扰剂量效应曲线均为线性,线性方程分别为 Y= 6.506 X + 88.867( r=0.997, P<0.05), Y=6.639 X + 357.067( r=0.996, P<0.05)。干扰效应的95% CI分别为(8.67±3.81) U/L、(19.67±13.16) U/L。
| 表3 Hb对AST检测干扰效应结果(U/L) |
20个参考值数据与60个参考值数的验证结果均在本实验室给出的参考区间内,见 表4。 说明本实验室转移《全国临床检验操作规程》(第3版)ALT、AST的参考区间符合临床要求。
| 表4 ALT 、AST生物参考区间验证实验结果(U/L) |
精密度是反映仪器整体性能的首要指标,是进行其他方法学验证实验的前提。EP5-A2是临床化学设备和检测系统精密度评价的常用标准。实验结果表明,罗氏的不精密度声明均可被接受。在确认检测系统精密度符合要求的基础上,进行准确度验证实验,结果显示,ALT、AST的准确度符合临床要求。
CLSI EP6-A2线性实验的多项式回归统计方法要求具有较高的检测精密度, 否则将会降低统计功效,因此实验前一般先用 SDr判断检测的精密度。结果显示,ALT、AST的 SDr均<目标 TEa 5%,线性评价有意义。SPSS13.0拟合结果显示ALT、AST检测的线性均覆盖仪器说明书给出的 4~600 U/L、4~800 U/L范围。CRR实验结果表明当稀释倍数达到1∶200时,ALT在1 202、1 427 U/L浓度均不能达到90%~110%回收率,当增加浓度至2 399 U/L时回收率才能达到可接受限,这提示ALT稀释后可靠检测浓度的低限(最小稀释度)可能在5~10 U/L。由于ALT、AST的医学决定水平为20、60、300 U/L,低值临床意义不大,可不进行分析灵敏度实验。所以ALT、AST的CRR为0~133 200 U/L和0~206 200 U/L,CRR范围较宽,完全可满足临床需要。
EP7-A2提供了2种干扰分析方法,即干扰筛选和用患者样本评价干扰。由于用患者样本评价干扰时需要ALT、AST参考方法或比较方法,本实验室暂不能提供。因此,本研究利用Sysmex A-PLUS干扰试剂盒,采用干扰筛选方法评估临床实验室的主要干扰(黄疸、溶血和脂血)。结果表明,Hb对AST酶动力学方法检测有正干扰,可能由于Hb在溶液中造成主吸收峰值降低和630 nm附近的吸收峰漂移所致。而这种漂移可由氧化(Fe2+ 、Fe3+ )、变构(温度、pH值)、变性(多聚体形成和四聚体降解)等一系列效应引起[ 8]。但临床样本溶血时AST从红细胞中释放对检测结果产生的 SE属于分析前效应,不属于干扰范畴。
C28-A2提供3种方法来评估参考区间转移是否可接受:(1) 系统性评审;(2) 20个参考值数据验证; (3) 60个参考值数据验证。系统性评审是通过认真审查原始参考值研究的有关因素来主观评价转移的可接受性。由于ALT、AST为常规生化项目,《全国临床检验操作规程》(第3版)提供了最新的参考区间。因此本研究选用后2种方法对其进行验证。结果显示,各验证结果均在给出的参考区间内,按照CLSI C28-A2判断标准,本实验室直接转移《全国临床检验操作规程》(第3版)提供的ALT、AST参考区间符合临床要求。
综上所述,罗氏 Modular 全自动生化分析仪ALT、AST检测的主要分析性能验证结果与厂商规定的分析性能基本一致,符合质量目标要求。本研究选用的验证方案具有可操作性和实用性。同时为定量检测项目方法学性能验证提供了一套较标准的方案,对临床实验室的标准化和认可具有重要意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|