作者简介:孙耀飞,男,1986年生,学士,主要从事泌尿系统肿瘤及尿动力学研究。
通讯作者:方祖军,联系电话:021-52887082。
前列腺癌好发于老年男性, 在欧洲是泌尿生殖系统中最常见的恶性肿瘤。2004年前列腺癌的新发病例占当年全部男性新发肿瘤的15.50%[1]。在我国, 2000年前列腺癌的发生率为4.55/10万男性人口, 虽然较欧美地区低, 但近年来呈上升趋势[2]。目前, 内分泌治疗仍然是前列腺癌的主要治疗手段之一, 尤其是无法行根治治疗的前列腺癌。而大多数的患者在经过14~30个月的有效期后, 几乎都要发展为激素非依赖性前列腺癌, 对于这部分患者缺乏有效的治疗手段, 中位生存期< 20个月[2]。目前有报道[3~5]称IL-6、染料木黄酮、褪黑激素等可以通过诱导前列腺癌细胞发生神经内分泌分化(neuroendocrine differentiation, NED)来抑制肿瘤的生长。色素上皮细胞衍生因子(pigment epithelium-derived factor, PEDF)是丝氨酸蛋白酶抑制物超家族中的一员, 因其具有抑制新生血管生成、诱导肿瘤凋亡等作用, 已被用于包括前列腺癌在内的多种肿瘤的治疗研究[6]。研究发现 PEDF能使视网膜母细胞瘤细胞Y-79发生NED, 并且将其发挥作用的部位定位于N端的一个44个氨基酸的肽段(44-mer, 57-101)[7]。44-mer能否诱导前列腺癌细胞发生NED, 以及其对前列腺癌是否具有治疗作用的报道甚少。我们通过人工合成44-mer对激素非依赖性前列腺癌细胞PC-3进行诱导, 从形态学改变和表达神经内分泌细胞标志物[神经特异性烯醇化酶(neuron-specific enolase, NSE)、嗜铬粒素A(chromogranin A, ChrA)]两方面确定其发生NED, 并就44-mer对前列腺癌的抑制作用进行初步研究。
44-mer由上海吉尔生化有限公司合成, 为使肽段性质稳定, 对肽段进行了C端酰胺化, N端乙酰化的修饰, 纯度> 95%, 质谱法检验合格, 二甲亚砜溶解, -20 ℃保存。激素非依赖性前列腺癌细胞PC-3购于上海中科院细胞库, RMPI 1640培养中添加10%胎牛血清培养。RMPI 1640为PAA公司产品, 胎牛血清购自美国GIBCO公司。ChrA酶联免疫吸附试验(ELISA)试剂盒为美国RD公司产品, 人NSE和ChrA抗体为美国proteintech公司产品(批号分别为10149-1-AP 、60135-1-Ig)。水溶性四氮唑(WST-1)、碘化丙啶(PI)试剂盒为江苏碧云天公司产品。
1.PC-3形态学改变的观察 100 nmol/L 44-mer诱导PC-3 6 d, 每2天换液1次。6 d后将PC-3置于倒置像差显微镜下观察。在10× 20倍镜下取3个随机视野, 每个视野数清细胞后, 计算发生NED的细胞百分率。
2.ELISA检测培养液中ChrA的含量 实验组:分别用1、10、100 nmol/L 44-mer诱导PC-3 3 d后取20 μ L细胞培养液, 根据产品提供的说明书完成ELISA检测。对照组:0 nmol/L 44-mer, 其余同实验组。
3.免疫印迹法检测PC-3中NSE、ChrA的表达 胰酶消化收集44-mer诱导6 d后的和空白对照组的PC-3, 提取蛋白Bradford法定量后, 取50 μ g总蛋白采用十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)电泳分离, 然后转至聚偏氟乙烯(PVDF)膜, 用TBST封闭1 h, 加入一抗(1∶ 800 NSE抗体、1∶ 1 000 ChrA抗体 )4 ℃过夜, TBST洗3次, 二抗室温孵育1 h。用增强的化学荧光素显像并摄片。
4.WST-1法检测细胞增殖 96孔板每孔加入PC-3细胞3 000个, 12 h后弃去原培养液, 加入不同的培养基, 每2天换液1次, 在第2、4、6天时每孔加10 μ L WST-1溶液, 37 ℃孵育2 h后用酶标仪在450 nm处测吸光度(A)值, 每个浓度设4个复孔, 重复3次。
5.流式细胞仪测细胞周期 用胰酶消化100 nmol/L 44-mer处理6 d后的PC-3, 离心收集, 磷酸盐缓冲液(PBS)洗2次后, 70%乙醇固定12 h后再次洗涤离心, 0.5 mL PI染色液37 ℃避光染色30 min。采用流式细胞仪进行细胞周期分析, 得出细胞各周期的百分率。
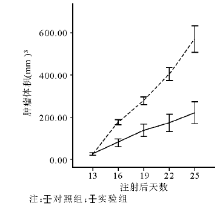
6.体内试验 将4~6个月的BALB/c雌性裸小鼠12只(购自上海中科院, SPF级条件下饲养)分成2组, 每组6只, 每只腋下注射2× 106个PC-3细胞, 肿块长至1003mm后实验组腹腔注射44-mer(10 mg/kg, 每2天1次共7次), 对照组腹腔注射PBS, 3 d测1次体积(体积=长× 宽2× 0.523)。实验结束后取样本10%甲醛浸泡固定后做免疫组化。
采用SPSS 11.6 软件系统, 各测定值以
在第6天对2组细胞进行形态学观察, 实验组中细胞丧失了正常PC-3均一的铺路石样的特征, 部分细胞呈狭长型, 并长出长的突起, 表明这部分细胞发生了NED[5], 见图 1。实验组有18.65%± 1.26%的PC-3发生NED, 而对照组仅为3.62%± 0.44%, 二者比较差异有统计学意义(P< 0.01)。
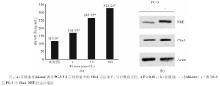
实验组分别用1、10、100 nmol/L 44-mer诱导PC-3 3 d, 其培养液中的ChrA水平分别为(168.97± 5.36)、(263.95± 5.30)、(325.24± 5.74) ng/mL, 对照组(0 ng/mL 44-mer)培养液中的ChrA水平为(115.97± 2.16) ng/mL。2组比较差异有统计学意义(P< 0.01), 见图2(a)。
NSE和ChrA是神经内分泌细胞标志物, 两者在实验组的PC-3中表达均有不同程度的升高, 这同ELISA的结果相吻合, 见图2(b)。
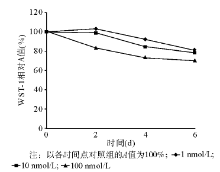
44-mer诱导PC-3生长到第6天时, 1、10、100 nmol/L 44-mer WST-1实验的A值分别为2.05± 0.07、1.98± 0.06、1.78± 0.09, 均低于对照组(2.54± 0.08)(P< 0.01), 见图3。
100 nmol/L 44-mer诱导PC-3 6 d后有79.24%± 3.24%的细胞处于G0/G1期, 而对照组有65.18%± 4.53%的细胞处于G0/G1期, 二者比较差异有统计学意义(P< 0.01), 表明44-mer的干预使更多的细胞停滞于G0/G1。
PEDF因其具有抑制新生血管生成、诱导肿瘤凋亡、神经营养功能而用于多种肿瘤和视网膜病变的治疗研究[6]。2003年, Doll等[8]发现PEDF基因缺失的小鼠前列腺明显增生, 人前列腺癌标本中PEDF表达降低或缺失。Guan等[9]通过腺病毒转染将外源PEDF基因导入PC-3中, 发现PEDF的表达抑制肿瘤细胞的生长, 表明PEDF对前列腺癌有治疗作用, 但机制仍不明确。PEDF的44-mer肽段可以诱导视网膜瘤母细胞Y79发生NED[9]。本研究通过体外合成44-mer对PC-3进行诱导干预, 一方面通过形态学上的观察发现加入44-mer后, PC-3 丧失了其正常的均一铺路石样的特征, 部分细胞呈狭长型, 并生出长的突起, 表明这部分细胞发生NED[5]; 另一方面神经内分泌细胞的标志物ChrA、NSE在实验组的表达量也明显升高, 这进一步验证了44-mer的干预使PC-3发生了NED。
目前NED对前列腺癌进展和预后有何影响尚不十分明确。前列腺癌中的神经内分泌细胞具有不表达雄激素受体(androgen receptors, ARs)、终分化、分泌多种产物的特点[10]。Spiotto等[11]发现信号传导蛋白和转录激活物3(STAT3)介导了IL-6对前列腺癌LNCap的前列腺癌的作用; 随后的研究[3]发现IL-6可以通过诱导LNCap的前列腺癌抑制肿瘤生长。Genistein可以诱导LNCap发生NED、上调表达磷酸化的STAT3和MARK, 而且发生NED的LNCap的培养液能够抑制PC-3和DU 145的增殖[4]。Sainz等[5]用褪黑激素对LNCap和PC-3进行了诱导, 均发生了NED而且生长增殖受限, 他们还发现这一作用不是通过褪黑激素的膜受体或蛋白激酶A实现的。Bostwick等[12]通过对手术切除标本进行免疫组化染色(ChrA和secretogranin)发现良性前列腺和无淋巴结转移的前列腺标本中的神经内分泌细胞明显多于淋巴结有转移的前列腺癌标本, 提示神经内分泌细胞的减少与前列腺癌的进展有关。这些发现均证明诱导前列腺癌细胞发生NED有一定的良性作用。
但是也有一些临床观察发现NED的增多与前列腺癌恶性程度的进展成正相关[13~17], 并且认为神经内分泌细胞标志物NSE[13]、ChrA[13~15]可以看作是前列腺癌预后的预测因素, 但是并没有直接证据显示肿瘤恶性程度的进展由于NED所致。在本研究中, 44-mer的体外干预使PC-3发生NED后, 细胞的增殖受限、处于G0/G1期的细胞数目增多, 这表明44-mer在体外通过诱导PC-3发生NED抑制肿瘤细胞的生长。体内实验的结果同体外实验是一致的, 44-mer的干预使更多的前列腺癌细胞表现出了神经内分泌细胞的特征, 并且抑制肿瘤生长。尽管44-mer诱导PC-3发生NED的机制目前不甚明了, 但本研究显示44-mer能诱导PC-3发生NED, 抑制肿瘤细胞的增殖, 减小前列腺癌体积。这将为临床治疗前列腺癌尤其是激素非依赖性前列腺癌提供新的思路和手段。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|