作者简介:尤海燕,女,1970年生,学士,副主任技师,主要从事免疫学实验工作。
通讯作者:焦志军,联系电话:0511-85026263。
调节性T(Treg)细胞是一群具有免疫抑制功能的细胞, 其能抑制效应T细胞的过度活化, 对维持机体免疫自稳、防止自身免疫病发生具有极其重要的作用。正常人外周血Treg细胞占CD4+T细胞的5%~10%, Treg细胞比例降低易引发自身免疫病[1]。目前认为叉头状转录因子FoxP3是Treg细胞的特异标志, 但由于FoxP3位于细胞核内, 需要破膜标记才能检测, 试验步骤繁琐。近年来有文献报道了Treg细胞的新标志物— — CD4+CD25+CD127low/-。因此, 我们采用流式细胞术检测类风湿性关节炎(rheumotaid arthritis, RA)患者外周血中CD4+CD25+CD127low/- T细胞的比例, 并分析其与传统CD4+ CD25+ FoxP3+ Treg细胞的相关性, 以探讨其在RA中的临床应用价值。
选取江苏大学附属医院2006至2008年住院及门诊活动期RA患者25例, 其中男2例, 女23例, 年龄17~53岁。所有患者均符合1987年美国风湿病学会修订的RA诊断标准, 并严格按照RA活动性诊断标准进行筛选。RA患者的临床参数为:红细胞沉降率(56± 29)mm/h, C反应蛋白(47.8± 19.6)mg/L, 类风湿因子(489.7± 398.1) IU/mL。以年龄和性别相匹配的25名健康献血员作为正常对照组。
流式细胞仪(FCM)为美国BD公司FACS Calibur。淋巴细胞分离液为上海试剂二厂产品。藻红蛋白(PE)荧光素标记的鼠抗人CD127及相应的同型对照IgG1-PE、FoxP3试剂盒[包括配套的固定/破膜剂、异硫氰酸(FITC)荧光素标记的鼠抗人CD4、别藻蓝蛋白(APC)荧光素标记的鼠抗人CD25、PE标记的鼠抗人FoxP3及相应的同型对照IgG2a-PE]均为美国eBioscience公司产品。
1.外周血单个核细胞(PBMC)的分离 抽取RA患者和正常对照者静脉血2.0 mL, 以乙二胺四乙酸钾(EDTA-K2)抗凝。用淋巴细胞分离液分离出PBMC, 以磷酸盐缓冲液(PBS)洗涤2次。调整细胞数约为1× 107/mL备用。
2.细胞染色 细胞染色的顺序是先进行细胞表面分子CD4、CD25及CD127的染色, 然后经过固定、破膜后再染胞内的FoxP3分子。操作步骤如下:取A、B 2支流式专用试管, A管用于CD4+CD25+CD127low/- T细胞的测定, B管用于CD4+ CD25+ FoxP3+ T细胞的测定, 分别取100 μ L上述PBMC悬液于2管中。A管中再加入10 μ L CD4-FITC、10 μ L CD25-APC、10 μ L CD127-PE(同时设同型对照反应管)后混匀, 室温避光反应15 min, 用冷PBS洗涤1次后, 以300 μ L冷PBS重悬细胞待测。B管中加入10 μ L CD4-FITC、10 μ L CD25-APC后混匀, 室温避光反应15 min, 冷PBS洗涤1次后加入1 mL新鲜配制的固定/破膜剂, 置4 ℃避光反应60 min, 而后以透膜缓冲液洗涤2次, 再加入10 μ L FoxP3-PE(同时设同型对照反应管), 室温避光反应30 min后洗涤, 以300 μ L冷PBS重悬细胞待测。
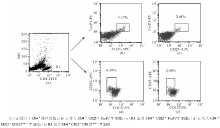
3. FCM检测 用Cell Quest软件获取10 000个细胞数据进行分析。 在CD4侧向散射光(SSC)点图上设门于CD4+淋巴细胞群, 分析其CD25、CD127、FoxP3的表达, 结果以百分比表示。
采用SPSS 12.0统计学软件进行分析, 数据以
FCM能准确识别CD4+CD25+CD127low/- 和CD4+CD25+ FoxP3+T细胞, 细胞分群明显, 见图1。
RA患者外周血CD4+CD25high、CD4+ CD25+ FoxP3+、CD4+CD25+CD127low/- T细胞占CD4+T细胞的百分率显著低于正常对照组(P均< 0.01)。见表1。
| 表1 RA患者及正常对照组CD4+CD25high、CD4+ CD25+ FoxP3+及CD4+CD25+CD127low/- T细胞占CD4+T细胞的比例 (%) |
相关分析显示, 正常对照组及RA患者CD4+CD25+CD127low/-T细胞比例与CD4+ CD25+ FoxP3+ T细胞比例之间均呈显著正相关(r分别为0.694、0.768, P均< 0.01)。
以往的研究将CD4+CD25high作为Treg细胞的标志, 但由于CD25high与CD25mediate的表达在FCM上没有明显的界限, 故难以对CD25high细胞进行精确设门, 因此应用CD25high通常会高估或低估Treg细胞的比例。后来随着FoxP3与Treg细胞特异性关系的建立, FoxP3开始成为检测Treg细胞敏感且特异的指标[2] 。但由于FoxP3位于细胞内, 检测时需对细胞进行破膜, 破膜后的细胞已失去活性, 无法再进行下一步的研究, 这使FoxP3的应用具有一定局限性。近年来发现, Treg细胞低表达CD127分子(CD127 low/-)[3], 且国外多个研究发现, 80%以上的CD4+ CD25+ FoxP3+ T细胞表达谱为CD4+ CD25+ CD127 low/-, 而85%以上的CD4+ CD25+ CD127 low/- T细胞表达谱为CD4+ CD25+ FoxP3+[3~5]。Liu等[6]发现CD127分子的表达水平与FoxP3呈负相关, 该分子对CD4+ Treg细胞的功能发挥起抑制作用。通过对1型糖尿病患者外周血Treg细胞亚群CD127分子的检测, 证明该分子可作为Treg细胞的标志物。本研究发现, 2组被测人群Treg细胞的3种标记法中都是CD4+CD25+CD127low/- T细胞比例最高, CD4+ CD25+ FoxP3+ T细胞比例次之, 且两者存在显著正相关, 这就提示CD4+ CD25+ CD127 low/-也可作为检测Treg细胞的指标。CD4+CD25+CD127low/- 标记法操作简便且无需破膜, 有利于Treg细胞的后续研究, 因而较CD4+ CD25+ FoxP3+ 而言, 以CD4+CD25+CD127low/-检测Treg细胞更简便。但FoxP3是反映Treg细胞功能的指标, 所以当需研究Treg细胞的功能时, 以CD4+ CD25+ FoxP3+ 为指标可能更为合适[7]。
RA是以关节的慢性炎症和骨质破坏为主要特征的自身免疫病, 其具体的发病机制尚未完全清楚。机体免疫调节功能的紊乱常被认为是RA发病的重要原因。Treg细胞是一群具有免疫调节功能的细胞, 以调节自身T细胞反应为主要功能, 其在维持机体的免疫耐受和抑制自身免疫反应方面起着至关重要的作用。本研究用CD4+CD25+CD127low/-标记法及Treg细胞的2种旧标记法检测了25例活动期RA患者外周血Treg细胞的相对数量, 发现RA患者外周血Treg细胞3种标记法的结果都显著低于正常人, 说明Treg细胞数量的减少可能在RA的发病中起了重要作用。RA患者外周血Treg细胞减少的原因可能是:(1)RA患者胸腺功能缺陷导致Treg细胞的产生受损; (2)Treg细胞向病变的关节内迁移导致其在外周血中的数量减少; (3)炎性细胞因子如白细胞介素-6(IL-6)等的大量增加导致Treg细胞的分化受抑制。Treg细胞作为效应应答的调控者, 在疾病中通过与靶细胞的直接接触和分泌抑制型细胞因子如白细胞介素-10(IL-10)等抑制自身反应性T细胞的增殖, 发挥负调控作用。由此推测, 可能正是由于这群具有免疫抑制功能的Treg细胞减少, 导致RA患者机体内负向调控机制紊乱, 不能抑制效应T细胞所引发的自身免疫反应, 从而引起免疫损伤。
综上所述, 以CD4+CD25+CD127low/-为标记检测Treg细胞简化了试验操作, 且其与CD4+ CD25+FoxP3+ 标记法之间存在良好的相关性, 为用膜表面分子CD127代替胞内分子FoxP3来鉴定Treg细胞提供了初步依据。今后我们将就RA患者Treg细胞与效应T细胞之间的相互作用机制做进一步研究, 以期为研究RA的病理机制与免疫治疗提供新的理论依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|