作者简介:林向华,女,1976年生,硕士,主管技师,主要从事临床检验工作。
通讯作者:刘仲明,联系电话:020-36653453。
近年来, 由禽流感病毒(avian influenza virus)引起的禽流感由于其高致病性和高死亡率成为人们关注的焦点[1]。现有的禽流感病毒检测技术耗时长, 操作繁琐[2~5]。压电免疫芯片是把抗原和抗体反应的特异性与石英谐振换能器对表面质量负载变化的高度敏感性相结合而发展起来的一种新型的生物传感器。该技术响应快, 既可定性又可定量, 克服了现有检测方法费时、昂贵、标记及操作繁琐等缺点, 具有极广泛的发展前景及临床应用价值, 成为生物传感器领域的研究热点[6]。但目前少见用于禽流感病毒快速检测的压电免疫芯片的报道。本实验室曾就禽流感病毒抗原固定方法进行过研究[7]。本研究尝试用聚乙烯亚胺(polyethyleneimine)-戊二醛交联法(简称戊二醛法)和葡萄球菌A蛋白(staphylococcal protein A, SPA)法将禽流感H5亚型单克隆抗体固定在石英晶体的金膜电极表面, 探讨适合用于构建检测禽流感病毒压电免疫芯片的抗体固定方法。
1.仪器 FPA-01型压电蛋白芯片分析仪(佛山分析仪有限公司); DK-S22型电热恒温水槽(上海精宏实验设备有限公司); FA1104电子天平(上海天平仪器厂)。
2.试剂 禽流感H5亚型单克隆抗体(华南农业大学兽医学院); 禽流感H5、H9亚型血球凝集抑制(hemagglutinin inhibition, HI)抗原(中国农业科学院哈尔滨兽医研究所); 丙酮、无水乙醇、Na2HPO4、NaH2PO4、NaCl(广州化学试剂厂); 聚乙烯亚胺(ICN Biomedicals公司); 戊二醛(上海化学试剂厂); 高纯氮气(广州军区广州总医院氧气房制); 牛血清白蛋白(BSA)、吐温20(广州威佳科技有限公司); SPA(本元正阳基因技术有限公司)。所用试剂均为分析纯, 试验用水为双重蒸馏水。
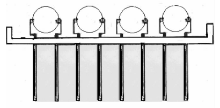
1.芯片设计 压电免疫芯片由弹簧支架、4个石英晶体并列组成。晶体采用AT切割, 直径5.0 mm, 双面镀金电极, 基频为10 MHz, 见图1。
2.芯片预处理 石英晶体芯片分别用丙酮、无水乙醇清洗3次后, 用双重蒸馏水反复清洗(直至前后2次双重蒸馏水清洗频率改变量在10 Hz以内, 视为洗净), 氮气吹干至频率稳定, 测基频(F1)。
3.生物敏感材料的固定 (1)戊二醛法固定抗体:首先在金膜电极表面滴加40 g/L的聚乙烯亚胺甲醇溶液5 μ L, 室温放置30 min, 分别用无水乙醇和双重蒸馏水清洗; 再滴加0.25 mol/L的戊二醛溶液10 μ L, 37 ℃下水浴30 min, 用双重蒸馏水清洗; 滴加禽流感H5亚型单克隆抗体溶液10 μ L, 37 ℃下温育1 h, 用双重蒸馏水清洗; 再滴加10 g/L BSA溶液, 37 ℃水浴1 h, 用双重蒸馏水清洗, 氮气吹干, 测频率(F0); (2)SPA法固定抗体:在金膜电极表面滴加1 g/L SPA溶液10 μ L, 37 ℃温育1 h, 用双重蒸馏水清洗; 再滴加禽流感H5亚型单克隆抗体溶液10 μ L, 37 ℃温育1 h, 用双重蒸馏水清洗, 氮气吹干, 测频率(F0)。
4.检测方法 (1)戊二醛法:直接滴加H5亚型HI抗原、磷酸盐缓冲液(PBS)对照各10 μ L至抗体石英晶体金膜上进行检测; (2)SPA法:先将禽流感H5亚型单克隆抗体与各自对应的HI抗原溶液或PBS等体积混合, 再将抗原抗体反应液滴加至固定了SPA的石英晶体金膜上, 37 ℃温育1 h, 用双重蒸馏水清洗, 氮气吹干至频率稳定, 测频率。
5.抗原及样本检测的判断标准 以抗原或样本对传感器的频率改变量△ FS为信号值, 以PBS对传感器的频率改变量△ FN为噪声值, 信噪比(S/N)=Δ FS/Δ FN。结果判读:S/N值≥ 2.1为阳性; 1.5≤ S/N值< 2.1为可疑; S/N值< 1.5为阴性[参考酶联免疫吸附试验(ELISA)的判断标准]。
数值以
将禽流感H5亚型单克隆抗体按比例稀释, 分别用戊二醛法和SPA法固定抗体, 固定量用频率改变量Δ F=F0-F1表示(F1和 F0分别是固定抗体前后的频率值)。
试验结果表明, 随着抗体浓度的减少, 石英晶体的频率改变量也随之减少, 即抗体固定量减少。2种方法的H5抗体稀释度均为1∶ 5时, 频率变化均不再随抗体稀释度的减少而明显增大, 说明抗体固定量趋于饱和。据此, 可以确定适合的抗体固定浓度。
戊二醛法和SPA法均以H5抗体稀释度1∶ 5固定, 检测不同稀释度(1∶ 2、1∶ 5、1∶ 10、1∶ 20、1∶ 40)的对应抗原溶液, PBS作对照, 观察石英晶体上的频率改变值, 用△ F2表示。结果显示, 戊二醛法抗原的频率改变量随抗原稀释度的增大而减少, 呈现负相关; 而SPA法抗原的频率改变量很小, 且不同稀释度抗原间未见显著性差异及相关性。于是针对SPA法, 尝试先将H5抗体与不同稀释度的对应抗原溶液混合, 并立即将反应液滴加至固定了SPA的石英晶体上, 37 ℃温育1 h。结果显示, SPA石英晶体对抗原抗体反应液有响应, 且抗原抗体反应液的频率改变量与抗原稀释度呈负相关。
用戊二醛法H5亚型压电免疫芯片分别检测H5、H9抗原溶液及PBS对照, 测定石英晶体的频率改变量△ F2。结果显示, PBS对照的△ F2为(18.23± 9.48)Hz, H5亚型压电免疫芯片对相应的H5抗原的△ F2 为(69.53± 17.03)Hz, S/N值> 2.1; 而H9抗原溶液用H5压电免疫芯片检测, △ F2 为(17.74± 9.22)Hz, S/N值< 1.5, 可见对H9抗原不存在交叉反应。
将H5、H9抗原溶液分别与H5抗体溶液结合, 再将反应液立即滴加至固定了SPA的石英晶体上, 以PBS作对照, 测定石英晶体的频率改变量△ F2。结果显示, PBS对照的△ F2为(23.00± 7.21)Hz, 对应的H5抗原抗体反应液的△ F2 为(107.00± 19.87)Hz, S/N值> 2.1; 而H9抗原-H5抗体反应液的△ F2 为(26.43± 9.94)Hz, S/N值< 1.5, 可见不存在交叉反应。
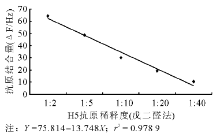
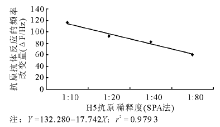
分别用2种抗体固定方法构建的压电免疫芯片对不同稀释度的禽流感H5亚型抗原进行检测, 以测定的频率改变量对抗原的稀释度作图, 见图2和图3。图2显示戊二醛法在H5抗原稀释度1∶ 2~1∶ 40范围内呈现较好的线性关系, 线性方程为Y=75.814-13.748X, r2=0.978 9。当H5抗原溶液稀释度低于1∶ 40时, 传感器的响应信号易被噪声淹没。因此该传感器的检测下限是1∶ 40, 线性范围为1∶ 2~1∶ 40。图3显示SPA法在抗原稀释度1∶ 10~1∶ 80范围内, 抗原抗体反应液的频率改变量与之呈负相关, Y=132.280-17.742X, r2=0.979 3。当H5抗原溶液稀释度低于1∶ 80时, 传感器的响应信号易被噪声淹没。因此该传感器的检测下限是1∶ 80, 线性范围为1∶ 10~1∶ 80。
用戊二醛法H5亚型压电免疫芯片和鸡胚分离法分别检测12份疑似H5样本, 试验结果为传感器法有8份阳性, 4份阴性; 鸡胚分离法有9份阳性, 3份阴性, 压电免疫芯片法与鸡胚分离法的符合率为91.7%, 2种方法的阳性检出率差异无统计学意义(P> 0.05)。
压电免疫芯片基于压电石英晶体传感器质量效应原理, 其利用石英晶体为换能器件, 将免疫反应的生物学信号转换成易于观察和检测的频率电信号, 通过计量晶体表面微小质量变化造成的晶体频率改变而达到检测目的[8~10]。其中免疫识别膜的固定化技术是压电免疫芯片制作的核心部分, 决定着压电免疫芯片的选择性、敏感性、稳定性和寿命等主要性能, 也决定着压电免疫芯片是否有研究和应用价值。因此, 抗体(抗原)的固定技术是免疫传感器性能好坏的关键。
SPA是金黄色葡萄球菌细胞壁正常组分中的一种多肽, 其可以通过分子间作用力直接吸附于石英晶体表面, 形成稳定的SPA-金复合物。SPA具有独特的优点, 其活性氨基能与IgG类抗体的Fc段特异性结合, 这种结合能使抗体与抗原决定簇发生键合的活动中心所在的Fab段裸露在修饰膜的外层, 从而不影响抗体与抗原的反应活性。SPA固定抗体有几何定向优势, 晶体表面有更多的抗体活性中心, 能键合更多的抗原[11]。但SPA并不能保证与所有种群所有亚型的抗体结合, 这在一定程度上影响了其应用[12]。本研究将H5抗体固定于石英晶体上, 虽然抗体的固定量不低, 但滴加相对应的抗原时, 却无法检测到抗原抗体反应的频率改变量。本研究尝试将H5抗体与对应的抗原溶液混合后滴加至固定了SPA的石英晶体上进行测定。结果表明SPA石英晶体可以和抗原抗体复合物结合, 并随着抗原稀释度的增加结合量逐渐减少, 而且与H9抗原溶液不存在交叉反应。虽然如此, 由于试验中游离抗体和抗原抗体复合物没有分离, 有可能部分游离抗体也与SPA石英晶体结合, 因此SPA法在禽流感病毒检测的应用上还有待于进一步研究。
戊二醛法是一种表面改性的共价偶联法, 其基本原理是利用涂敷于晶体电极表面的聚乙烯亚胺的氨基通过双功能试剂与蛋白质相连。由于通过共价键结合, 抗体的结构更趋稳定。但这种共价结合的方式是随机的, 我们无法估计抗体在多大程度上保留了抗原结合能力, 抗体同晶体间或邻近抗体之间发生空间位阻效应的可能性增加。这些都影响了试验结果的敏感性、特异性, 特别是使压电免疫传感器的组内变异和组间变异加大, 进而影响试验的可重复性[13]。
本研究中, 戊二醛法构建的压电免疫芯片与SPA法相比, 重复性和线性均优于SPA法, 并能满足检测要求, 可对禽流感病毒抗原进行快速检测, 与鸡胚分离法有较高的符合率。该方法操作简单, 结合牢固, 使用试剂价格低廉, 通过控制试验条件, 可以提高传感器的敏感性和缩短反应时间, 具有快速检测禽流感病毒的应用前景, 有希望成为一种实用的检测方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|