作者简介:徐建华,男,1976年生,硕士,副主任技师,从事临床生化与分子生物学研究。
通讯作者:庄俊华,联系电话:020-81887233-32908。
近年来, 由于生化检测项目的日渐丰富, 全自动生化分析仪的大量引入, 以及临床对检测结果精度的重视, 样本中共存干扰成分对结果的影响越来越受到大家的关注。2005年, 美国临床实验室标准化协会(CLSI)通过了EP7-A2文件— — 《临床化学干扰试验— — 批准指南》(第2版)。该文件利用2种实验方案进行干扰评价试验。第1种方案为“ 干扰筛选” (将潜在的干扰物添加到样本中评价干扰效应)。把一个潜在的干扰物质添加到测试组中, 然后评价相对于未加干扰物的对照组的偏倚, 即“ 配对差异” (paired-difference)实验。如果引起的偏倚无显著临床意义, 则该物质不是干扰物质, 无需进一步实验。反之, 具有显著临床意义的偏倚的物质被认为是干扰物, 这些物质需要进一步评价, 以确定干扰物浓度和干扰程度两者之间的关系, 即“ 剂量效应” (dose-response)实验。第2种方案为“ 利用患者样本作偏倚分析” 评价干扰效应。为最大程度的减少患者血清样本中可能遇到意想不到的干扰情况的发生, 该方法将分析来自患者的真实样本以评价内在的不同血清样本间的变异性。如果某个样本中出现一个可重复的“ 离群值” , 则说明该样本中有潜在的干扰物质存在。可重复的与样本相关的高“ 离散度” 偏倚将能很好地证明干扰物质的存在。我们利用EP7-A2文件第1种实验方案, 采用Sysmex 公司已开发上市的A-Plus干扰试剂盒对PA测定的干扰情况作一评价。
Roche Modular PPI全自动生化分析仪。前白蛋白(PA)试剂盒为国产试剂。干扰试剂盒为日本Sysmex 公司A-Plus试剂盒(批号:ZS6004), 包括游离胆红素(FBil)、结合胆红素(CBil)、血红蛋白(Hb)、乳糜及相应的空白。
取实验当天新鲜血清(无溶血、黄疸和脂血)制备成混合血清, 其浓度应达到EP7-A2文件推荐的分析物浓度水平。
1.样本准备 (1)基础样本:参考EP7-A2文件推荐的分析物浓度水平, 每个分析物选择2个浓度(PA分别为100和400 mg/L)的新鲜血清(无溶血、黄疸、和脂血)作为基础样本; (2) 贮存液和空白液:A-Plus试剂盒内含FBil、CBil、Hb、乳糜4种干扰物及空白对照冻干粉, 2 mL蒸馏水复溶后分别作为贮存液和空白液; (3) 测试样本和对照样本:依据试剂盒说明书及实验要求, 用基础样本分别以1∶ 9、1∶ 5、1∶ 20、1∶ 20比例稀释4种干扰物的贮存液和空白液作为测试样本和对照样本, 稀释后测试样本中FBil、CBil、Hb和乳糜的浓度分别是0.2、0.4、2.41 g/L和835浊度。
2. 重测次数的确定 首先计算最大允许干扰值(dmax)/批内标准差(s)比值, 然后查dmax/s与重测次数对应表(见表1), 可得出PA 2个浓度水平重复测定次数。s通常由基础样本重复测定10次, 计算可得; dmax为各项目临床意义差别的标准。本研究参照卫生部室间质评临床可接受范围, 设定PA的dmax为基础样本均值的12.5%。
| 表1 dmax/s与重测次数对应表 |
3. 检测要求 按交互顺序检测测试样本和对照样本。如果检测系统受携带污染影响, 可增加额外的样本使对照样本免受来自测试样本携带污染的影响, 增加的额外对照样本结果应舍弃。
4. 干扰效应分析 将所得数据进行干扰效应的“ 点估计” , 即dobs(dobs =
1.样本准备 (1)基础样本和贮存液:同“ 配对差异实验” ; (2)高浓度样本(H):用基础样本稀释贮存液, 制备成所需的浓度; (3)低浓度样本(L):参照对照样本的制备方法, 用基础样本稀释空白液; (4)测试样本:制备一系列包含中间浓度干扰物的测试样本, 以高浓度样本和低浓度样本按一定比例的混合而成, 通常5个浓度足够确定一个线性的剂量效应关系, 其配置要求方法为:L、75%L+25%H、50%L+50%H、25%L+75%H、H。
2.重测次数的确定 通常为3次, 也可根据EP7-A2文件提供的统计公式计算每个浓度水平的重测次数。
3.检测要求 在同一分析批内测定5个系列浓度样本。为平均系统漂移产生的影响, 第1次按升序测定, 第2次按降序, 第3次再按升序, 以此类推。
4.剂量效应分析 (1)线性效应:如果数据随机分布, 成一条直线, 可用最小二乘法进行回归分析, 确定其斜率、截距、标准误(Sy, x)(每个点而非平均值), 在图上绘制回归线; (2)非线性效应:如各浓度水平的干扰不是一个线性函数, 绘图时显示是弯曲的, 则利用非线形二次多项式公式计算给定的干扰物浓度的干扰度。
1.重测次数的确定 计算dmax/s比值。低浓度基础样本10次测定的PA均值为77.4 mg/L、dmax为9.68、s为 0.97; 高浓度基础样本10次测定的PA均值为306.4 mg/L、dmax为38.3、s为1.35; PA 2个浓度水平的dmax/s均> 3。查表1可知, PA高、低浓度水平的重测次数为3次。
2.干扰效应结果 利用Roche Modular PPI全自动生化分析仪检测PA时, 0.2 g/L FBil、0.4 g/L CBil、2.41 g/L Hb对PA无干扰。835浊度的乳糜水平时, 低浓度PA 的dobs 和dc分别为-3和2.36(-dobs> dc), 高浓度PA的dobs 和dc分别为-7.67和2.84(-dobs> dc), 表明835浊度的乳糜水平对PA低、高浓度水平检测有负干扰, 其干扰效应的95%CI分别为(6.21± 2.73) mg/L、(14.23± 7.95)mg/L。
1.重测次数的确定 根据EP7-A2文件的通用要求, 本研究每个浓度水平的重测次数为3次。
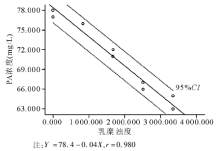
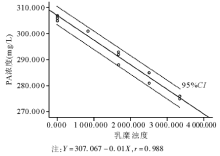
2.剂量效应分析 参照干扰物在血清中影响实验的最高浓度水平, 对贮存液进行相应稀释后, 乳糜的最高干扰物浓度(H)为3 340浊度。对PA测定可产生线性负干扰, 干扰效应结果见表2。低浓度PA的线性方程为Y =78.4-0.04X, r=0.980; 高浓度PA的线性方程为Y=307.067-0.01X, r=0.988。剂量效应回归分析图分别见图1、图2。
| 表2 乳糜对PA检测的干扰剂量效应结果 (mg/L) |
患者结果与真值间的偏离主要有3个原因, 包括系统偏差、不精密度、干扰。对临床实验室来说, 分析干扰评价试验可以验证和确认干扰声明, 研究明确的干扰物质引起的结果差异。1986年8月, CLSI公布了EP7-P文件(《临床化学干扰试验— — 推荐指南》)[1]; 后经修改审定, 于2002年12月发布了EP7-A文件(《临床化学干扰试验— — 批准指南》)[2]; 进一步完善和补充相关内容后CLSI于2005年11月通过了EP7-A2文件[3]。EP7-A2提供了2种分析干扰评价方案:(1)干扰筛选; (2)利用患者样本作偏倚分析。由于用患者样本评价干扰时需要参考方法或具有低干扰性和高特异性的比较方法, 以确定在比较研究中的“ 真值” , 一般常规实验室很难满足其要求。因此, 本研究利用日本Sysmex公司的A-Plus干扰试剂盒, 采用干扰筛选方法评估临床实验室的主要干扰(黄疸、溶血和乳糜)。实验结果表明, 乳糜浊度对PA免疫透射比浊法检测有负干扰, 并可通过EP7-A2文件提供的统计公式分别计算其不同浓度水平处干扰效应的95%CI。当配对差异实验提示有干扰时, 应利用剂量效应系列实验方案进一步确定干扰物不同浓度水平的干扰度。剂量效应回归分析图表明, 乳糜≤ 3 340浊度(人血清中上限水平)时, PA低、高2个浓度水平的干扰剂量效应回归方程均为一次线性负干扰。通过线性回归方程, 干扰物不同浓度的干扰度可被估计, 即各干扰物浓度引起的干扰效应为各分析物测定值(X为干扰物浓度时, Y值的大小)减去低浓度样本测定值(X为0时, Y值的大小)。
EP7-A2提供的2种实验方案都有其优点和内在局限性, 目前没有一种有效的干扰试验方法能够鉴别所有的干扰物。“ 干扰筛选” 方案由于是人为加入干扰物, 存在一些局限性:(1)添加到血浆中的化合物的特性可能不同于那些在体内自然循环状态下的化合物; (2)实验样本基质并不代表典型的有问题的临床样本; (3)样本中真实的干扰物可能不是原来的药物, 而是代谢产物; (4)试验浓度水平可能选择太低或太高以至不真实。“ 利用患者样本作偏倚分析” 实验方案是目前唯一能够检测药物代谢产物干扰的方法, 亦是可肯定在真实样本中存在干扰的一种方法。但该方案对实验变异缺乏控制对照, 亦存在一定的局限性:(1)只能证明偏倚和估计的干扰物质某水平的相关性, 不能证明因果关系; (2)患者通常服用多种药物, 难以证实何种药物的干扰作用; (3)干扰物可能不存在于患者的测试样本中; (4)就干扰而言, 比较方法可能没有足够的特异性, 另外, 一些项目很少有公认的参考方法, 有时参考方法也难以在临床实验室中使用并可能也同样的被干扰; (5)按照疾病和治疗药物进行预期分组可能难以完成; (6)样本不新鲜时, 一些不稳定的组分可能丢失。2种实验方案可提供互为补充的信息, 因此两者结合起来应用可更好的用于分析干扰评价。
血清质量对临床化学检验的干扰必须得到广大检验医学工作者的高度重视, 仪器生产商也应改进分析软件, 为给临床提供可靠的检验结果, 除正确选择干扰消除方法外, 将反映样本溶血、黄疸及脂血程度的血清指数随检验结果一并报告亦非常必要[4]。利用已开发上市的干扰试剂盒, 依据CLSI EP7-A2文件, 应用SPSS或SAS医学软件进行统计分析, 是一个具有一定的应用价值的分析干扰评价方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|