作者简介:吴爱武,女,1966年生,硕士,主任技师,主要从事常见病原菌耐药性研究。
耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)是金黄色葡萄球菌(Staphylococcus aureus, SA)获得甲氧西林耐药决定子— — mecA基因后产生的一种高耐药性菌株, MRSA几乎对所有β -内酰胺类抗菌药物耐药[1], 对其他临床常用抗菌药物如红霉素、四环素等常常也表现为耐药。MRSA的耐药基因主要位于葡萄球菌盒式染色体mec(staphylococcal cassette chromosome mec, SCCmec)上, 其药敏谱与SCCmec的结构有一定的相关性。目前SCCmec有5个大的分型, 在各个分型中又有具体亚型[2]。SCCmec分型是区分医院感染和社区获得性感染的一个重要指标[3]。社区获得性MRSA的多重耐药性没有医院获得性MRSA严重, 但社区获得性MRSA的致病性较强, 含有多种毒力基因, 大多数含有PV杀白细胞素(Panton-Valentine leukocidin, PVL), PVL可引起白细胞死亡及组织坏死, 感染了产PVL的SA后常造成严重疾病[4]。为了解目前临床分离的SA药敏状况、MRSA的SCCmec基因分型及PVL基因的携带状态, 我们对临床分离的SA进行了药敏检测, 并对筛选出的MRSA应用聚合酶链反应(PCR)及多重引物PCR进行SCCmec基因分型及PVL基因检测。
1.菌株来源 所选菌株为2007年7月至2008年6月广州医学院第一附属医院临床标本中分离的SA 102株。质控菌株为SA(ATCC 25923)和已知MRSA(mecA基因检测阳性)。
2.培养基 药敏培养基为水解酪蛋白胨(MH)琼脂。
3.抗菌药物纸片 苯唑西林、头孢西丁、万古霉素、四环素、庆大霉素、复方磺胺甲口恶唑、诺氟沙星、克林霉素、环丙沙星均为中国药品生物制品检定所产品, 在有效期内使用。
4.试剂 细菌基因组DNA提取试剂盒、溶菌酶由天根生物工程有限公司提供; TaqDNA酶、dNTP由宝生物工程有限公司提供; 凝胶纯化回收试剂盒由TaKaRa公司提供。1× 三羟甲基氨基甲烷(Tris)-乙酸(TAE)电泳缓冲液、琼脂糖、5 μ g/mL溴化乙锭 (EB)、10× PCR缓冲液、无菌生理盐水、三蒸水。
5.主要仪器 超净台、-70 ℃低温冰箱、水浴箱、36 ℃恒温孵箱、PTC-200 PCR仪、DYY-Ⅲ 型稳压稳流电泳仪、英国Syngene 全自动凝胶成像系统。
| 表1 SCCmec基因分型及PVL基因检测所用引物 |
1.抗菌药物纸片琼脂扩散法检测SA药物敏感性 用纸片琼脂扩散法测定SA(含质控菌株)对苯唑西林、头孢西丁、万古霉素、四环素、庆大霉素、复方磺胺甲口恶唑、诺氟沙星、克林霉素、环丙沙星9种抗菌药物的药物敏感性。结果判读:使用游标卡尺测量抑菌圈直径(mm), 结果按2007年美国临床实验室标准化协会(CLSI)M100-S17文件[6]中的标准判定敏感、耐药或中介。
2.MRSA检测 采用CLSI推荐的头孢西丁纸片扩散法进行MRSA检测。凡SA对头孢西丁的抑菌圈直径≤ 21 mm, 判断为MRSA; 如果抑菌圈直径≥ 22 mm, 判断为甲氧西林敏感金黄色葡萄球菌(MSSA)[6]。
3.DNA模板的制备 具体操作步骤参照试剂盒内说明书进行。
4.SCCmec多重PCR 根据文献[5]记载的PCR扩增反应体系和条件, 采用多重PCR检测SCCmec基因。扩增产物电泳后全自动凝胶成像系统观察结果并拍照保存。
5.PCR检测PVL基因 根据文献[5]记载的PCR扩增反应体系和条件进行PVL基因扩增。扩增产物电泳后全自动凝胶成像系统观察结果并拍照保存。
6.SCCmec基因扩增片段凝胶回收、测序及分析 采用TaKaRa公司的DNA凝胶回收试剂盒从琼脂糖凝胶中回收扩增出的目的基因SCCmecⅢ 和SCCmecⅣ a, 送上海博亚公司进行目的基因测序。测序结果在NCBI网站(http://www.ncbi.nlm.nih.gov/BLAST/)上进行GenBank BLAST比对, 以确认扩增出的序列是否与已知序列一致。
102株SA中有39株对头孢西丁耐药, MRSA的检出率为38.2%(39/102)。
采用纸片琼脂扩散法检测39株MRSA和63株MSSA以及质控菌株AS(ATCC 25923)对9种临床常用抗菌药物的敏感性, 质控菌株的药敏结果均在规定的范围内, 试验菌株的结果见表2。MSSA对β -内酰胺类抗菌药物均敏感, 而MRSA则耐药。MSSA对这些常用抗菌药物耐药率由高到低分别为:克林霉素(39.7%)> 复方磺胺甲口恶唑(31.7%)> 四环素类(22.2%)> 喹诺酮类(14.3%)> 氨基糖苷类(6.3%)> 糖肽类(0.0%)。MRSA对大环内酯类100%耐药, 对其他药物表现为多重耐药, 主要耐药模式为同时对氨基糖苷、大环内酯、四环素、磺胺4类药物耐药, 其耐药率由高到低分别为:大环内酯类(100.0%)> 喹诺酮类(92.3%)> 氨基糖苷类(74.4%)> 四环素类(71.8%)> 磺胺类(66.6%)> 糖肽类(0.0%)。
| 表2 39株MRSA和63株MSSA对9种抗菌药物的药敏结果 (%) |
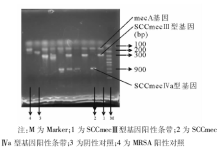
39株MRSA均可检测到mecA基因, 检测到SCCmecⅢ 型基因(280 bp)28株, 占71.2%, 检测到SCCmecⅣ a型基因(776 bp) 4株, 占10.3%, 同时检出SCCmecⅢ 型和 SCCmecⅣ a型基因1株, 有7株为未分型菌株。阳性基因结果见图1。
SCCmecⅢ 和SCCmecⅣ a基因测序结果经GenBank BLAST比对, 2个产物分别与已知目的基因(GenBank的登陆号是AB037671.1和AB266531.1)序列完全一致。
39株MRSA中均未检测到PVL基因。
自1961年在英国发现世界首例耐甲氧西林菌株, 进而将SA划分为MSSA和MRSA以后, MRSA逐渐成为全世界医院感染的主要病因。在中国, 上海地区MRSA的发生率在20世纪80年代前为5%, 1985至1986年为24%, 20世纪90年代后为70%[7], 其他地区的报道一般也在40%~70%之间[8]。在广州地区, 1998年12家医院葡萄球菌药敏监测结果显示, SA中MRSA的检出率为42.4%(72/170)[9]。本研究结果显示102株SA中MRSA占38.2%(39/102), 与1998年的结果相比MRSA的检出率稍下降。有报道显示, 随着广谱抗菌药物的广泛应用、介入治疗、腹膜透析、静脉留置导管等技术破坏了人体正常防御机制, MRSA的检出在临床上有下降趋势, 取而代之的是耐甲氧西林的凝固酶阴性葡萄球菌(MRCNS)成为医院感染的重要病原菌[10]。在本地区引起医院感染的葡萄球菌中是否也出现这样的趋势, 有待进一步研究。
从本研究的药敏试验结果可看出, MRSA对6类临床常用抗菌药物的耐药率均比MSSA高, 且表现为多重耐药, 对大环内酯类的耐药率最高, 糖肽类最低。而2006年长春市对84株来自多家医院分离出的SA耐药性检测则显示, 对大环内酯类、四环素类耐药率较高, 分为55.4%、51.8%; 对糖肽类100.0%敏感, 磺胺类较敏感, 敏感率为97.6%; 对其他抗菌药物有不同程度耐药。两者比较可发现, 两地的SA均对大环内酯类抗菌药物耐药率最高, 对四环素类、喹诺酮类等也有不同程度的耐药。因此, 临床上在确定为SA感染的情况下, 不应将这几类抗菌药物作为经验用药所使用的药物。还有一点较大区别是, 本研究中MRSA菌株对磺胺敏感性较低, 这也许是地区用药差异所致, 可在将来进一步进行大范围耐药监测加以验证。
科学家们已对8株有代表性的SA(MRSA252、N315、Mu50、COL、MW2、MSSA476、NCTC 8325、RF122)进行了全基因组测序分析[3]。根据基因组结构分析得知, mecA基因为SA对β -内酰胺类抗菌药物耐药的耐药基因, mecA基因及其他耐药基因均位于一个可移动元件— — SCCmec上[2]。目前, SCCmec分为5种类型即SCCmecⅠ ~Ⅴ , 对临床分离的MRSA进行SCCmec分型是区分医院感染和社区获得性感染的一个重要指标。医院获得性的MRSA菌株常常携带的是Ⅰ 、Ⅱ 或Ⅲ 型SCCmec中的1种, 而社区获得性MRSA或非多重MRSA(NORSA)菌株携带的是Ⅳ 型SCCmec。MRSA的SCCmec分型同时也是衡量菌株耐药性的一个重要标志, 携带Ⅰ 型的菌株为原型株, 含耐药基因少, 除对β -内酰胺类抗菌药物耐药外对其他抗菌药物敏感, 多重耐药率低; Ⅱ 型菌株携带的耐药基因较Ⅰ 型多, 耐药基因的数量和种类在不同的地区有区别; Ⅲ 型菌株是携带耐药基因数量最多、多重耐药率最高的菌株, 耐药谱在不同地区间区别很大; Ⅳ 和Ⅴ 型菌株除携带mecA外不带其他耐药基因[3]。
本研究中, 39株MRSA菌株以SCCmecⅢ 型为主, 占71.2%, SCCmecⅣ a占10.3%, 有7株为未分型菌株, 说明临床分离的MRSA菌株中以医院获得性MRSA为主, 少数是社区获得性MRSA。经查阅患者资料发现, 39例均来自住院患者的标本, 但也不能排除患者是在社区内感染出现症状后, 经门诊就诊再转送至病房治疗的可能性, 即4株属于SCCmecⅣ a型的菌株可能还是经社区内感染而来的。根据相关文献报道, 欧美地区的MRSA以SCCmecⅠ 型和Ⅳ 型为主, 亚太地区( 包括中国、印度、印度尼西亚、菲律宾、沙特阿拉伯、新加坡、 斯里兰卡、台湾、泰国、越南) 以Ⅲ 型为主, 但日本、韩国则以Ⅱ 型为主[11]。本研究的结果显示, 临床标本中分离的MRSA也是以Ⅲ 型为主, 与报道相符, 说明本研究大多数的MRSA感染均为医院内感染。这也提示在医院感染控制中, 医院获得性MRSA的防控形势非常严峻, 需密切注意。另外未分型的7株MRSA则没有出现除mecA以外的其他基因条带, 这种暂时未能分型菌株的出现可能有2种原因, 一是本研究运用了多重PCR, 所有引物均以相同条件进行扩增, 可能该菌株的耐药基因所需要的PCR扩增条件与其他基因不一样, 导致扩增不出相应的条带; 二是可能这7株菌有SCCmec基因盒以外的新的耐药基因或其他耐药机制, 这有待今后进一步研究。值得注意的是, 本研究中出现了1株既有SCCmecⅢ 型又有SCCmecⅣ a型基因的MRSA, 该菌株是否是患者在社区感染后进入医院后再获得SCCmecⅢ 型基因, 有待进一步研究。
医院获得性MRSA是引起院内感染的多重耐药菌, 几乎对所有β -内酰胺类抗菌药物耐药, 对其他临床常用抗菌药物如红霉素、氯霉素、四环素也耐药, 而社区获得性MRSA感染来自社区, 其耐药性与医院获得性MRSA明显不同[3]。本研究的结果也部分显示了这点, 从表3可以看出, 检出SCCmecⅢ 型基因的菌株(医院获得性MRSA菌株)对6种非β -内酰胺类抗菌药物(克林霉素、复方磺胺甲口恶唑、环丙沙星、诺氟沙星、庆大霉素)的耐药率大多高于检出SCCmecⅣ a型基因的菌株(社区获得性MRSA)。携带SCCmecⅢ 型基因的菌株对环丙沙星、诺氟沙星100%耐药, 但携带SCCmecⅣ a型基因的菌株对其全部敏感, 2类菌株均对克林霉素耐药。由于本研究检出的携带SCCmecⅣ a型基因的菌株数量较少, 其药敏结果也许不具有普遍性, 具体有待今后进一步验证。
有报道, 世界上最近流行的社区感染MRSA产PVL的比例非常高, 达77%~100%[12], 社区获得性MRSA的多重耐药性没有医院获得性MRSA严重, 但社区获得性MRSA的致病性较强, 含有多种毒力基因, 大多数含有PVL。PVL是坏死性细胞毒素, 能够破坏人类白细胞, 引起严重的组织损伤, 与儿童、成年人发生的坏死性皮肤损伤和严重的坏死性肺炎有关, 由于产PVL的SA的毒力非常强, 感染后与疾病的严重程度相关[13], 因此对临床标本中分离出的MRSA进行PVL基因的检出非常必要。但本研究在39株临床分离的MRSA中均未检出PVL基因, 可能与检出的MRSA绝大多数来源于住院患者有关。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|