作者简介:王静,女,1968年生,硕士,副主任技师,主要从事血液学及输血研究。
通讯作者:傅启华,联系电话:021-38625568。
血小板无力症(glanzmann's thrombasthenia, GT)是一种少见的常染色体隐性遗传性出血病, 其原因是血小板膜上整合素α Ⅱ bβ 3质或/和量的缺陷, 导致患者血小板对多种生理性诱聚剂反应低下或缺如, 影响正常的止血功能。患者终身存在出血倾向, 其出血表现呈现多样性, 即GT的分子缺陷与临床出血症状的严重程度无明显相关性。我们对1例临床诊断为GT的患者进行了相关基因缺陷检测。
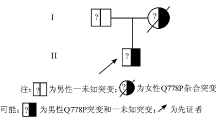
1. 先证者 男, 6岁, 自幼有皮肤瘀斑史, 躯干及下肢内侧经常有自发性出血点和淤青。本次因鼻衄10 d, 伴黑便, 发热39 ℃就诊, 曾输用药物止血敏、冷沉淀物、凝血酶、维生素C、维生素K、血浆等, 均未达到止血效果, 就诊后鼻腔填塞压迫止血。患者父母为非近亲婚配, 母亲因病出血感染而死亡。家系图见图1。家系标本的采集均经受试者或其监护人知情同意。
2. 正常对照组 共100名, 男52名, 女48名, 上海儿童医学中心门诊体检健康儿童, 平均年龄(5.7± 2.8)岁。
1. 标本采集 采集先证者及家系成员静脉血标本。1份以乙二胺四乙酸二钾(EDTA-K2)抗凝, 用于血小板计数及流式细胞术检测。另1份分3管, 以0.109 mol/L柠檬酸钠1∶ 9抗凝, 第1管用于凝血指标检测, 第2管用于血小板聚集功能检测, 第3管用于抽提DNA, -80 ℃冻存。
2. 凝血相关指标检测 凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、纤维蛋白原(FIB)的检测采用ACL9000全自动血凝仪, 配套试剂、校准品及标准参比液等为美国IL公司产品。
3. 血小板相关指标检测 血小板计数采用Sysmex 800i血液分析仪, 原装配套试剂、e-check质控品均为日本Sysmex公司产品。血小板聚集功能测定采用Chorono-Log 560 Vs血小板聚集仪, 以2 μ mol/L ADP、0.4 U/L凝血酶、2 μ g/mL胶原、0.5 mmol/L花生四烯酸、0.4 μ g/mL肾上腺素、1.2 μ g/mL瑞斯托霉素为激活剂。血小板膜糖蛋白(platelet glycoprotein, GP) Ⅱ b(CD41)/Ⅲ a(CD61)含量检测采用COULT EPICS XL流式细胞仪, 原装配套试剂、质控品为美国Beckman-Coulter公司产品。
4. 出血时间检测 采用Ivy法, 使用BD末梢采血器和水银血压计。实验中针刺深度为2 mm, 维持加压40 mmHg, 每隔30 s用干净滤纸吸干流出的血液。
5. GPⅡ b/Ⅲ a基因测序 按试剂盒RelaxGene Blood DNA System(北京天根生化科技有限公司产品)说明书提取先证者基因组DNA。聚合酶链反应(PCR)扩增试剂为上海申能博彩生物科技有限公司产品, 包括5 U/μ L Taq DNA聚合酶、10× Buffer、10 mmol/L dNTP。引物参照NCBI GenBank中GPⅡ b/Ⅲ a基因序列(序列号NG008331)设计并由上海申能博彩生物科技有限公司合成, 所用仪器型号为Biometra TGradient。PCR反应总体积50 μ L, 包括1× Buffer、2 U Taq DNA聚合酶以及dNTP(终浓度为200 μ mol/L)、相应引物对(引物终浓度为0.5 μ mol/L)和MgCl2 (终浓度为1.5 mmol/L)。扩增条件:95 ℃ 5 min, 然后95 ℃ 变性30 s, 56~62 ℃退火30 s, 72 ℃延伸30~60 s, 30个循环后72 ℃ 10 min。PCR产物经虾碱酶(上海申能博彩生物科技有限公司产品)纯化后采用ABI 3730 DNA测序仪直接测序。家系成员仅在先证者基因突变区域进行基因检测。
6. 基因多态性排除 对健康对照组DNA进行相应区域的PCR扩增、测序, 进行多态性排除。
先证者凝血常规检测结果:APTT为35.1 s[正常对照组为(35± 10) s], PT为13.2 s[正常对照组为(13± 3) s], TT为15.2 s[正常对照组为(17± 3) s], FIB为4.1 g/L(正常对照组为2.0~4.0 g/L)。出血时间> 40 min, 24 h血块退缩不良。血小板计数为267× 109/L。血小板聚集功能异常, 对多种生理性诱聚剂反应低下, 包括二磷酸腺苷(ADP)、凝血酶、胶原、花生四烯酸、肾上腺素, 其最大聚集率均< 2%, 但对瑞斯托霉素反应正常, 最大聚集率为65%。流式细胞术检测结果显示血小板膜上CD41和CD61的表达显著降低, 阳性率分别为1.36%和5.23%。正常对照组CD41和CD61阳性表达率分别为94.1%± 4.3%和95.0%± 4.6%。血涂片中血小板散在, 大小不均, 无聚集现象, 骨髓涂片巨核细胞成熟障碍。
GT由瑞士儿科医生Eduard Glanzmann于1918年首先报道, 为罕见的常染色体隐性遗传性出血性疾病。其病因是GPⅡ b(CD41)/Ⅲ a(CD61)数量减少或质量异常, 导致血小板聚集功能障碍和血块收缩功能不良。
GPⅡ b/Ⅲ a(整合素α Ⅱ bβ 3)通常以复合物形式分布于血小板和巨核细胞表面, 是血小板膜的主要受体, 也是血小板膜上含量最多的膜糖蛋白[1]。在静息状态下, 平均每个血小板约有80 000个α Ⅱ bβ 3分子, 其中70%分布在血小板表面, 其余则储存于膜连接的管道系统和胞质的α 颗粒内。α Ⅱ bβ 3分别由定位于17号染色体的q21-23片段内的ITGA2B和ITGB3基因单独编码。GPⅡ b基因(ITGA2B)包含30个外显子, 编码1 039个氨基酸, GPⅢ a基(ITGB3)包含l5个外显子, 编码778个氨基酸。α Ⅱ bβ 3介导活化的血小板与FIB、vWF因子、纤维连接蛋白、凝血酶、胶原等粘附蛋白结合[2], 导致血小板聚集, 发挥血小板的止血功能。当血小板活化时, 内池的GPⅡ b/Ⅲ a向外释放, 复合物空间构型发生改变, 其上的FIB受体位点暴露与血FIB结合, 发挥止血作用[3]。此外, FIB与GPⅡ b/Ⅲ a的结合还可引起跨膜信息传递, 导致血小板的进一步活化和释放反应, 这些正反馈作用加速了血小板血栓的形成。GPⅡ b/Ⅲ a是钙依赖性异二聚体, 在Ca2+的参与下, α Ⅱ b和β 3亚基以1∶ 1比例构成23 nm的复合物[4, 5], 是一个完整的功能单位。因此其正常生物合成不仅需要各个亚基的正确构像, 而且需要两者相互作用才能形成复合物。当其表达减少或者功能异常时都可能导致血小板不被激活、出血和止血障碍。未形成复合物的α Ⅱ b会迅速降解, 而β 3则可以和α v形成Vitrorectin的受体α vβ 3, α vβ 3可以存在于血小板、巨核细胞、内皮细胞、破骨细胞等表面。
GT可分3型。Ⅰ 型GT血小板表面GPⅡ b/Ⅲ a含量小于正常的5%, 活化的血小板不能结合FIB, 血块缺乏回缩反应; Ⅱ 型GT血小板表面GPⅡ b/Ⅲ a为正常的10%~20%, 活化的血小板可少量结合FIB, 血块回缩异常; Ⅲ 型GT为变异型(结构异常), 血小板表面GPⅡ b/Ⅲ a为正常的50%~100%, 但活化的血小板不能结合或仅少量结合FIB, 血块回缩从缺乏到正常。
本例先证者凝血常规正常, 血小板计数正常, 但出血时间> 40 min, 24 h血块收缩不良。血小板聚集功能异常, 除瑞斯托霉素外, 对多种生理性诱聚剂反应低下。CD41和CD61含量均显著降低, 分别为1.36%和5.23%。血涂片中血小板散在, 大小不均, 无聚集现象, 骨髓涂片中巨核细胞成熟障碍。先证者表型检测符合I型GT诊断。
通过对先证者GPⅡ b/Ⅲ a序列的PCR产物直接测序, 发现GPⅡ b基因外显子E23存在18183A> C杂合突变, 导致编码的谷氨酰胺为脯氨酸所替换, 产生Q778P (Gln778Pro)的变异。经检索http://sinaicentral.mssm.edu/intranet/research /glanzmann数据库, 证实该突变已在多个GT家系中有报道[6]。因此基因诊断明确了该突变是导致先证者产生GT的分子发病机制之一。
家系调查发现, 先证者父亲和伯父均无此突变基因, 基于流式细胞术的检测结果和GT的遗传规律, 推断另一突变也存在于先证者的GPⅡ b基因中, 因此推测其因感染出血而病故的母亲可能携带此突变。虽然通过表型检测和GPⅡ b/Ⅲ a基因外显子区测序分析, 可以对血小板膜糖蛋白缺陷症进行实验诊断, 但是由于GPⅡ b/Ⅲ a基因庞大, 结构复杂, 其庞大的内含子区序列的突变也可能对其功能产生影响。在对先证者的GPⅡ b/Ⅲ a基因所有外显子及其侧翼含拼接点的内含子进行测序分析后, 也发现了一些位于内含子区域的基因变异(数据未列)。这些内含子区的基因变异是否会对其转录功能产生影响, 进而影响编码GPⅡ b/Ⅲ a基因的功能, 还有待于进一步研究。从方法学的角度出发, PCR技术结合测序的方法对于一些大片段缺失和突变存在漏检现象。此外, 蛋白翻译后修饰异常、空间结构异常、整合素亚单位的转运异常、整合素的信号传导系统的异常等[7, 8]都能导致GT的发生, 却不一定能找到基因突变。因此, 仅仅通过对外显子区测序分析或cDNA测序分析, 一些遗传性GT的基因缺陷还是不能被完全发现。
GT是一种遗传性出血性疾病, 没有现行有效的治疗指南[9], 目前主要的治疗手段是止血和支持对症处理。血小板输注是最主要和有效的止血方法, 但反复输注血小板可能引起输注耐受, 主要原因是产生了抗血小板GPⅡ b/Ⅲ a的同种抗体, 采用一次性血浆交换去除同种抗体可以取得较好输血效果, 同时局部止血在治疗GT局部出血中具有重要作用。基因治疗GT也正处于积极研究中[10], 希望不久的将来可以通过造血干细胞移植治愈GT。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|