作者简介:颜怀军,男,1969年生,学士,主管技师,主要从事临床生化检验工作。
脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2, Lp-PLA2)是一种不依赖于钙存在的磷脂酶A2, 主要由单核细胞和巨噬细胞合成和分泌[1], 其特异性地水解动脉内膜下氧化低密度脂蛋白(LDL)上的氧化卵磷脂, 其反应产物溶血卵磷脂胆碱和氧化游离脂肪酸可促进动脉斑块内的炎症反应导致斑块易损[2]。近来流行病学研究表明Lp-PLA2酶的活性是冠心病和缺血性中风的独立危险因素[3]。Kolodgie等[4]采用Lp-PLA2抗体的免疫组化技术, 显示Lp-PLA2大量表达在易损、破裂斑块的坏死核心和巨噬细胞周围, 而在非进展性病变的斑块中表达则较弱。这些发现提示Lp-PLA2具有促进斑块发展的潜在作用。目前对于影响Lp-PLA2活性因素的研究不多, 且均在白种人中进行的。最近一个独立的全基因组关联分析(genome-wide association study, GWAS)研究显示在白种人群中载脂蛋白C-1(Apo C-1)的基因多态性与血浆Lp-PLA2的活性的升高密切相关[5], 但目前尚不清楚中国汉族人群是否存在影响Lp-PLA2活性的基因型。鉴于该酶活性与动脉粥样硬化病的关系, 我们选取了浙江地区汉族成年人群以探讨Apo C-1的基因多态性与血浆Lp-PLA2活性的关系, 以及与血脂代谢各项生化指标的关系。
收集从2006至2008年在空军杭州疗养院进行健康体检的浙江地区汉族成年男性756例, 平均年龄 47 岁, 体检时记录患者的体重指数(BMI)和血压。
1. 血浆Lp-PLA2基因型的检测 采用乙二胺四乙酸(EDTA)抗凝的真空采血管采集静脉血, 使用QIAamp DNA Blood Mini Kit试剂盒(Qiagen, 德国)按照说明书提取DNA。采用Primer 3 软件 (http://frodo.wi.mit.edu/)针对Apo C-1基因的rs4420638单核苷酸多态性(SNP)位点设计扩增引物, 由上海生工生物工程有限公司合成。上游引物为5'-AGGTCACAC-AGCCAGGAAGT-3', 下游引物为5'-GCTGAGATC-GCACCACTGTA-3', 扩增片段长度为189bp。反应体系包括:DNA模板1 μ L, 10× PCR buffer 2.5 μ L, MgCl2(25 mmol/L) 1.5 μ L, 上、下游引物(50 mmol/L)各0.5 μ L, dNTP(10 mmol/L) 2.0 μ L, SYTO 9(1.5 μ mol/L)染料0.75 μ L, Taq 聚合酶(5 U/L)0.125 μ L, 最后去离子水补足25 μ L。 PCR扩增条件为:95 ℃预变性2 min; 然后95 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 30 s, 共40个循环; 72 ℃ 延伸2 min, 10 ℃停止。然后在Rotor-Gene Q(Qiagen, 德国)) 进行高分辨熔解(HRM)曲线分析, 条件为:95 ℃ 2 min, 60 ℃ 2 min预处理后, 熔解温度从 75 ℃到 95 ℃, 每升高0.1 ℃采集1次数据。获得高分辨熔解曲线图, 进行分析。
2. 测序分析 为进一步证实HRM检测基因型的正确性, 随机抽取20个DNA样本, 用上述引物在美国ABI 9700扩增仪上扩增, PCR扩增条件同上, 产物送上海生工生物工程技术服务有限公司测序。
3. Lp-PL A2活性的检测 血浆样本储存于-80 ℃, 检测前取出使其溶解, 使用由美国Cayman 公司提供的Lp-PLA2试剂盒活性检测试剂盒, 按照说明书进行检测血浆中Lp-PLA2活性, 并根据说明书提供的公式 计算Lp-PLA2活性。
Lp-PLA2活性[μ mol/(min· L)]=△ A405/min÷ 10 mmol/L× 0.225 mL÷ 0.01 mL× 1/4
4. 血脂代谢指标的检测 空腹状态收集静脉血, 用贝克曼LX20生化分析仪(美国贝克曼公司)检测血葡萄糖(Glu)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C), 低密度脂蛋白胆固醇(LDL-C)。
不同基因型个体的血脂代谢指标和Lp-PLA2活性比较应用t 检验, P< 0.05表示差异有统计学意义。
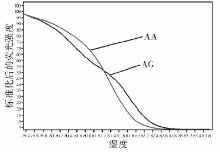
通过PCR 扩增出特异性片段, 大小符合预期(图1)。将此产物进行HRM, 检测Apo C-1 rs4420638 多态性获得2种类型曲线的标准视图, 经测序后得知分别代表2种的基因型:AA基因型、AG基因型, 在所有个体中未发现GG基因型。2种基因型在男性分布分别为:76.1%、23.9%。AA基因型曲线随温度升高荧光下降较快, AG基因型为杂合子型稳定性较差, 所以在较低的温度就开始解链(图2)。HRM法可以清晰地区分2种基因型。采用HRM法与测序法比较, HRM检测Apo C-1 rs4420638基因多态性的准确率为100.0%(图3)。
携有AA基因型个体的平均年龄、BMI、收缩压、舒张压分别为48.4岁、25.7 kg/m2、 16.5 kPa(124 mmHg)、10.0 kPa(75 mmHg); 而携有AG基因型个体的平均年龄、BMI、收缩压、舒张压分别为46.8岁、25.3 kg/m2、16.3 kPa(122 mmHg)、9.86 kPa(74 mmHg)。我们分析该人群的基因型与临床资料的关系, 发现AA基因型的Lp-PIA2 活性水平和LDL-C 水平明显低于AG基因型, 而Glu、TC、TG、HDL-C浓度在2基因型间的差异无统计学意义, 结果见表1。
| 表1 AA及A/G基因型生化指标分析 ( |
Lp-PLA2是由粥样硬化斑块内的炎症细胞分泌的一种酶, 也被称为血小板活化因子乙酰水解酶(PAF-AH), 具有促进炎症的作用。Lp-PLA2通过去除LDL表面氧化的磷脂酰胆碱, 产生2种具有促炎功能的溶血磷脂酰胆碱和氧化的非酯化脂肪酸[6]。Lp-PLA2近来成为生物炎性标记研究的一个热点, 因为从动脉粥样硬化的最初形成到斑块易损性都与其有关, 提示该酶具有促动脉粥样硬化作用, 是冠心病的独立危险因素, 有可能成为冠心病新的治疗目标。目前已经出现针对Lp-PLA2开发的药物, Lp-PLA2抑制剂能够有效的抑制Lp-PLA2 活性, 阻止冠心病患者斑块坏死核心容积扩展, 减低斑块易损性[7]。
鉴于Lp-PLA2在促动脉粥样硬化中的重要作用, 有必要从遗传学的角度来研究基因变异如何影响Lp-PLA2活性。国外的一项GWAS研究发现有六个基因位点可以显著影响Lp-PLA2的活性, 其中差异最具有统计学意义的是Apo C-1 rs4420638 位点[5], 鉴于中国汉族人群在遗传结构与白种人存在较大不同, 本研究旨在中国浙江地区汉族成年男性体检人群中检测Apo C-1 rs4420638 位点是否影响Lp-PLA2活性。
本研究对成年男性健康体检人群中Apo C-1 rs4420638的多态性进行了检测。结果发现在中国汉族成年男性中, AA及AG基因型的频率分别为76.1%、23.9%, 未出现GG型的纯合子突变, 等位基因的频率为A 88.0%, G 12.0%。G 等位基因的频率显著低于Suchindran等[5] 的报道(G 16.0%), 这反映了不同人种之间的遗传变异。本研究中同时检测了血脂生化指标, 结果发现纯合子AA基因型的携带者较杂合子的AG型者具有更低的Lp-PLA2活性水平[AA型(149.8± 36.2) μ mol/(min· L), AG型(178.7± 38.3) μ mol/(min· L)], 趋势与先前的研究相一致[5], 由于Lp-PLA2活性是心血管病事件的危险因素, rs4420638 的G 等位基因可能是中国人冠心病的遗传性易感因素之一。在本研究还发现Apo C-1 rs4420638 AG 型个体中的LDL浓度也相对较高。目前已经知道Lp-PLA2分泌入外周血时大部分与LDL结合, 可能是因为后者Apo B构型更有助于Lp-PLA2的结合。也有研究指出LDL水平高的个体也具有较高的Lp-PLA2的活性[8], 这与本研究相符。因此有理由相信, Apo C-1 rs4420638 AG型个体可能通过体内较高的LDL 浓度导致Lp-PLA2活性的升高。但此结论还需要进一步实验来证明。
本研究首次在汉族人群中发现Apo C-1 的基因型与炎症因子Lp-PLA2活性密切相关。遗传因素在Lp-PLA2活性调节中的作用及确切机制尚有待于更深入的研究, 明确他们之间的关系, 筛查高危人群, 将为动脉粥样硬化性疾病的早期诊断及防治提供新的线索。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|