作者简介:王伟平,女,1977年生,学士,主管技师,主要从事临床微生物学与分子生物学检验工作。
通讯作者:张仙森,联系电话:0576-84287963。
支原体是人类泌尿道常见寄生菌之一, 在正常情况下不致于对人体造成伤害, 在特定条件下可以致病, 如滥用抗菌药物造成菌群失调, 使得支原体大量繁殖。支原体在自然界分布广泛, 迄今已分离到150多种, 从人体分离出的有15种[1]。目前认为与人体泌尿生殖道疾病密切相关的有4种, 即微小脲原体(Ureaplasma parvum, Up)、解脲脲原体(Ureaplasma, Uu)、人型支原体(Mycoplasmal hominis, Mh)、生殖支原体(Mycoplasma genitalium, Mg) [2, 3]。目前支原体检测的方法主要有病原培养法和血清学方法, 但灵敏度或特异度都不高, 聚合酶链反应(PCR)具有高通量、快速、样品用量少、灵敏度高、特异性强、污染少等特点, 本研究采用巢式PCR技术检测泌尿生殖道致病性支原体, 对1份生物样品同时检测出多种致病性支原体, 避免了误诊、漏诊率, 提高了诊治效率。
2009年8至2010年2月在台州市第一人民医院皮肤性病科、泌尿外科、妇产科门诊就诊者, 疑为泌尿生殖道感染的患者72例, 分别进行了Up、Uu、Mh和Mg检测, 其中男40例, 女32例, 年龄16~58岁, 平均年龄32.6± 16.8岁。
美国ABI公司的ABI PARISM 7000型全自动荧光定量扩增PCR仪; PCR反应试剂盒购自大连宝生物有限公司。
1. 标本采集 在用药前或停药1周后采集标本。男性患者:先清洁尿道口, 将棉拭子伸入尿道1~2 cm, 轻轻旋转3~5次捻取分泌物, 将取样后的棉拭子插入配套的备有1 mL无菌生理盐水试管中, 盖紧管盖, 立即送检。女性患者:采样前3 d内未使用阴道内药物或冲洗阴道, 24 h内无性行为, 避开月经期采集; 采集时先用消毒棉签擦去宫颈口过多的分泌物, 再将消毒棉拭子插入宫颈1~2 cm, 轻轻旋转3~5周, 停留10~20 s取样, 以保证获得较多的柱状上皮标本。将取样后的棉拭子插入配套的备有1 mL无菌生理盐水试管中, 盖紧管盖, 立即送检。
2. 标本保存 采集样品2~8℃保存不超过24 h, -20℃保存不超过30 d, 避免反复冻融。
采用文献报道中最常见的4种泌尿生殖道致病性支原体[2, 3]及NCBI的GenBank数据库(AF073457、AF073450、AY466443、M96660)中支原体16S~23S DNA序列, 用DNAStar5.0软件进行多序列比对, 对各支原体进行同源性分析比对后设计出两对通用引物, 引物由上海生工合成, 序列为:引物1(5'TGTGATAGCGGTTAAATGCGT AGT3'); 引物2(5'GTGGAGCAAATAGATTAGATA CC3'); 引物3(5'TTGTCGTCAGGTCGTATCGTG 3') ; 引物4(5'GTCCCGTCAACTGAGCGCAAC3')。
标准株由南京铁道医学院赵季文教授惠赠(Up:ATCC27813; Uu:ATCC27814; MgATCC33530; Mh:为临床分离株, 经法国生物梅里埃公司鉴定证实)
首轮PCR反应条件为95℃预变性5 min, 94℃变性45s, 55℃退火45 s, 72℃延伸45 s, 35个循环。巢式PCR反应条件为94℃变性45 s, 54℃退火45 s, 72℃延伸30 s, 共35个循环。扩增产物理论大小为300bp左右。
取5 μ L扩增产物以2%的琼脂糖凝胶电泳, 经溴化乙锭染色后紫外灯下观察结果。300bp处出现明显条带为阳性。
每次反应严格设阳性与阴性对照, 避免假阳性和假阴性。
上述扩增产物经API PRISM 310型DNA自动测序仪上进行测序, 测序引物(5'TTGTCGTCA GGTCGTATCGTG3')。测序结果与GenBank数据库进行DNA同源性比较以鉴别不同型别支原体。
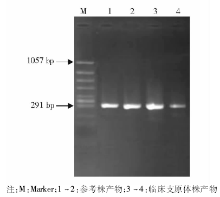
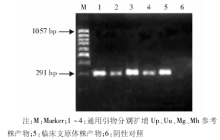
用引物3、引物4扩增上述扩增产物, 产物长度约为300bp, 取5μ L扩增产物以2%的琼脂糖凝胶电泳, 结果Up、Uu、Mh和Mg参考株均扩增出300bp基因片断, 见图2。72例泌尿生殖道感染的患者经PCR扩增, 其中阳性65例, 阳性率90.3%, 与一步法PCR扩增阳性率75.0%相比, 差异有统计学意义(χ 2=5.857, P< 0.05), 见表1。
| 表1 巢式PCR与一步法PCR检测结果比较 (n) |
测序结果与GenBank数据库进行DNA同源性比较结果如下:65例泌尿生殖道感染的患者中Uu感染30例, Up感染14例, Mh感染12例, Mg感染9例。
支原体是一类缺乏细胞壁、形态上呈高度多形性, 能通过除菌滤器, 在无生命培养基中生长繁殖的最小原核细胞型微生物。众所周知沙眼衣原体(Chlamydia trachomatis, Ct)是引起非淋菌性尿道炎(nongonococca urethritisl, NGU)的主要病原体, 但其中支原体的致病作用也不容忽视。有研究发现在非Ct感染的NGU患者中, 45.7%有支原体检出阳性[4], 国内有报道称NGU患者中支原体的感染率甚至高于Ct[5] 。Maeda等[6]报道日本男性NGU患者Mg、Uu、Up、Mh的感染率分别为23.8%、18.8%、8.8%、2.6%, 并认为Mg与Uu为NGU持续感染及再复发的主要病原体。支原体体外生长缓慢, 其中生长最快的Uu作选择性培养也需 1周时间, 而生长最慢的Mg则需2~3个月甚至更长的时间, 因此支原体培养不适宜临床的早期快速诊断。利用血清学方法检测各支原体抗体, 则属间接指标, 且支原体属内种类繁多, 不同种的支原体存在交叉免疫反应(如肺炎支原体mycoplasmal pneumoniae 与Mg), 有些支原体同种不同株抗原间也存在异质性(如Mh)且诊断标准与时间难以掌握, 检测非特异性较高, 也不适合临床广泛应用[7]。
巢式PCR运用核酸分子杂交的原理, 具有高通量、快速、样品用量少、灵敏度高、特异性强、造价低、污染少等特点。因此可能解决支原体培养和血清学方法检测的问题, 对1份生物样品可同时检测4种病原体, 即Up、Uu、Mg、Mh进行检测, 通过1次试验可筛查上述4种病原体的感染, 且可以用于混合感染的标本的检测, 必将降低我国性传播性疾病的误诊、漏诊率, 提高诊治效率, 做到早期诊断, 及时治疗, 同时也为流行病学研究提供一个新的有效手段。因此巢式PCR技术在致病性支原体的研究中具有广泛的应用前景。曹军等[8]对肾癌组织标本中的支原体感染情况进行了检测, 结果发现免疫组织化学检测和巢式PCR 检测阳性的检出率分别为64.2% 和81.1%, 提示2种检测方法相比较, 巢式PCR是一种较免疫组织化学敏感度更高的检测方法。国外对支原体诊断的研究中研究较早的是日本的Takashi [9], 采用PCR扩增及系统进化分析法对13种支原体和两群Uu进行鉴定, 由于不同支原体和Uu间的亚克隆化及序列的差异, 使得该方法的特异性不高。在此基础上随后又研制了PCR-微量滴定板杂交的方法, 对泌尿道的Up、Uu、Mg、Mh进行检测, 探讨这些病原体与NGU及其他泌尿生殖道感染的关系并确定这些病原体的当前流行状况[10]。本研究选择4种支原体16SrRNA基因, 在GeneBank中获取Up(4个血清型)、Uu(10个血清型)、Mg及Mh相关序列, 同源性分析发现四者在16SrRNA基因区进化中存在差异, 证明该区可用于分群分型研究。从临床样品的检测结果看, 巢式PCR检测的阳性率为90.2%, 一步PCR检测的阳性率为75.0%, 差异有统计学意义(χ 2=5.857, P< 0.05)。一步PCR检测方法由于受到灵敏度的限制, 极易造成漏检。因此, 本研究建立的巢式PCR方法更适宜于泌尿道Up、Uu、Mg、Mh的检测, 特别是对感染早期和中期的检测。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|