作者简介:张海晨,男,1973年生,副主任技师,主要从事实验室管理和生化检验工作。
斯钙素(stanniocalcin, STC)是一种糖蛋白激素, 人类STC家族由STCl和STC2组成, STC以自分泌或旁分泌方式参与机体多种生理病理的调节, 多项研究报道人STC1基因在多种肿瘤组织中高表达, 而在非肿瘤人群的骨髓和外周血中不表达, 因此推测STC1可能成为一个新的肿瘤标志物[1, 2], 目前未见STC1基因在肺腺癌患者外周血中的表达研究。本研究拟检测肺腺癌患者外周血STC1基因的表达, 并与临床病理资料和常规血清肿瘤标志物检出率进行比较, 以探讨STC1基因是否可以作为诊断肺腺癌的循环标志物。
收集2009年8月至2010年1月上海市徐汇区中心医院和上海市第六人民医院肺腺癌初发患者45例, 所有患者均经病理学证实, 其中男29例, 女16例; 年龄≤ 60岁18例, 年龄> 60岁27例; 按美国癌症联合委员会系统(AJCC)对肺腺癌患者进行TNM标准分期。另收集52名健康对照者, 其中男37名, 女15名; 年龄≤ 60岁22名, 年龄> 60岁30名。
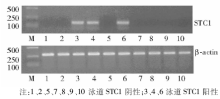
取400 μ L静脉血乙二胺四乙酸(EDTA)抗凝离心后弃去血浆, 采用 Trizol试剂提取总RNA, 并反转录成cDNA, 以cDNA为模板, Taq DNA聚合酶催化下, 进行聚合酶链反应(PCR)扩增。STC1基因引物序列(5'→ 3')如下: CACACC CACGAGCTGACTTC, TCTCCCTGGTTATGCACTC TCA, 长度为140 bp。
血清肿瘤标志物CEA、CA125、CA211、NSE的检测采用美国雅培公司生产的ARCHITECT i-2000SR电化学发光全自动免疫分析仪及试剂盒, 采用化学发光微粒子免疫分析(CMIA)技术, 两步法对待测样品的相关抗原进行定量测定, 检测步骤严格按照仪器和试剂盒说明书进行操作。参考范围:CEA < 10 ng/mL、CA125 ≤ 35 U/mL、CA211 < 3.3 ng/mL、NSE < 30 ng/mL。
用SAS6.12软件进行数据分析。组间比较采用卡方检验或确切概率法检验。STC1基因与其他肿瘤标志物检出率的比较采用McNemar检验。受试者工作特征(ROC)曲线分析采用MedCal软件分析。
45例肺腺癌患者TNM标准分期:T1-T2期13例, T3-T4期32例; 临床分期Ⅰ -Ⅱ 期8例, Ⅲ -Ⅳ 期37例; 无淋巴结转移者7例, 有淋巴结转移者38例; 无远处转移者17例, 有远处转移者28例。45例肺腺癌患者外周血STC1基因表达阳性率为48.89% (22/45); 而52名健康成人的外周血中则无1名出现阳性。在肺腺癌Ⅰ -Ⅱ 期和Ⅲ -Ⅳ 期之间STC1基因的表达差异有统计学意义(P< 0.05); STC1基因的表达在有无淋巴结转移之间差异有统计学意义(P< 0.05); 而其他各组间差异无统计学意义(P> 0.05)。见图1、表1。
| 表1 肺腺癌患者外周血STC1基因表达与临床病理关系 |
本研究对45例肺腺癌患者的血清CEA、CA125、CA211、NSE蛋白浓度进行了检测, 并采用McNemar检验分别与STC1基因表达作比较。 STC1与CEA阳性比较:χ 2=0.125, P> 0.05, 2种方法检出率基本一致; STC1与CA211阳性比较:χ 2=13.066 7, P< 0.05, 2种方法检出率不同; STC1与CA125阳性比较:χ 2=4.591 4, P< 0.05, 2种方法检出率不同; STC1与NSE阳性比较:χ 2=19.047 6, P< 0.05, 2种方法检出率不同; 联合CEA、CA125、CA211、NSE 4种标志物中1项指标阳性即为阳性进行比较:χ 2=0.166 7, P> 0.05, 2种方法检出率基本一致。见表2。
| 表2 STC1基因与血清肿瘤标志检出率比较 |
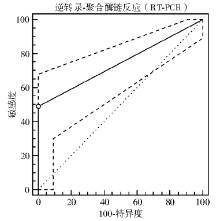
用ROC曲线进行灵敏度和特异度的综合评价, 发现ROC曲线下面积为0.744(95%可信区间:0.646~0.828, P< 0.01), 见图2。提示STC1作为肺腺癌的循环肿瘤标志物可能具有较高的诊断价值。
肿瘤标志物是特征性存在于恶性肿瘤细胞或由恶性肿瘤细胞异常产生的物质, 亦是宿主对肿瘤发生反应时产生的物质。这些物质存在于肿瘤细胞和组织中, 也可以进入血液和其他体液, 当肿瘤发生、发展时, 这些物质明显异常, 提示肿瘤的存在。CEA、CA211、CA125、NSE是目前最常用的肺癌标志物, 它们对肺腺癌均有一定的诊断意义, 但也有一定的局限性[3]。从外周血中发现敏感特异的肿瘤标志物, 用于早期诊断、预测肿瘤复发或远处转移, 是近年来肿瘤实验诊断学的一个热点。目前用来检测血液中肺癌细胞的高特异性肿瘤标记物比较少, 而且有许多在血液的正常细胞中也有表达。因此, 对血液中潜在的肺癌细胞检测仍然没有一种十分有用的临床分子标记物。
新近研究发现, STC蛋白, 尤其是STC1可能在人类肿瘤的发生发展过程中起重要作用。STC1最初是作为肿瘤相关基因被克隆的。当STC1全长序列被检测出以后, 先前发现的一种在乳腺癌(3/14例)中表达下调的cDNA后来被鉴定为STCl的3'UTR, 这表明STC1在肿瘤中起一定的作用, 目前不断增加的资料更是表明STC1 基因在肝癌、结肠癌、乳腺癌、卵巢癌、甲状腺髓样癌组织等多种肿瘤中的表达变化显著[1, 2, 4, 5]。在肿瘤细胞中高STC1含量可能反应这些细胞对磷(Pi)的高代谢需求。胡卫东等[6]研究发现乳腺癌组织的STC1 mRNA阳性率达93.2%, 乳腺癌患者外周血中的STC1 mRNA的阳性率为37.3%, 骨髓标本中STC1 mRNA表达阳性率为37.5%。而作为阴性对照的17例非肿瘤女性患者外周血STC1 mRNA均阴性反应, 提示STC1可作为用来诊断乳腺癌外周血及骨髓微转移的肿瘤分子标记物, 与现阶段国内外广泛应用的一些肿瘤标记物如CEA、细胞角蛋白、上皮膜样抗原等相比具有较高的敏感性和特异性。
本研究采用RT-PCR方法检测了45例肺腺癌患者外周血中的STC1基因表达情况, 阳性率为48.89% (22/45), 另将实验结果与肺腺癌患者临床病理资料综合分析显示:STC1基因表达与肿瘤的临床分期、淋巴结转移有显著相关性。因此, 肺腺癌患者外周血中表达STC1基因则提示该肿瘤有高度恶性的生物学行为。作为对照组的52名健康成人的外周血中STC1基因表达均为阴性。
通过对45例肺腺癌患者血清CEA、CA125、CA211、NSE蛋白浓度检测, 分别与STC1基因表达作比较, 结果发现, STC1与CEA阳性检出率比较基本一致(P> 0.05); STC1阳性检出率比CA211、CA125、NSE均高(P< 0.05); STC1与联合CEA、CA125、CA211、NSE 4种标志物中1项指标阳性即为阳性进行比较, 结果发现检出率基本一致(P> 0.05)。经ROC曲线进行灵敏度和特异度的综合评价, 发现ROC曲线下面积为0.744(95%可信区间:0.646~0.828, P< 0.01)。因此, 本研究结果提示STC1作为肺腺癌的循环肿瘤标志物可能有比较高的辅助诊断价值。STC1基因有望成为肺腺癌一个新的肿瘤标志物。但是, 本研究的病例数较少, STC1基因其临床应用价值还需结合临床病理资料进行更深入的评价。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|