作者简介:刘晓峰,男,1965年生,学士,副主任技师,主要从事临床检验工作。
恶性肿瘤细胞的重要生物学特性是其对周围组织的侵袭和破坏,并在远隔器官形成转移灶。其涉及肿瘤细胞与宿主间多环节、多步骤的复杂过程,包括肿瘤细胞转变,原位脱落和侵袭,内渗和播散,郁积、黏附和外渗,异位生长和增殖,其中细胞黏附参与整个过程并起重要作用,而介导细胞黏附作用的是一大类细胞黏附分子[ 1]。细胞黏附分子参与介导肿瘤细胞与宿主细胞及细胞外基质的相互作用,按其结构可分为5类:免疫球蛋白超家族(IgSF)、钙黏素家族(cadherins)、整合素家族(integrins)、选择素家族(selectins)以及尚未归类的一些受体家族,如多配体聚糖(syndecan)、CD44[ 2, 3]。我们将阐述这5类细胞黏附分子基本结构及其功能,继而探讨其在肾癌侵袭转移中的作用。
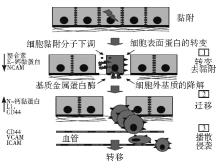
IgSF是人类基因组中最大的蛋白超家族,其典型的结构是含有I型跨膜糖蛋白,大多数成员 N端胞外区至少包含一个类似于免疫球蛋白的结构域(这种结构域有分子识别的作用)[ 4]。继Williams及其同事首次认识IgSF以来,已经在人类发现765个成员。一般IgSF可分为2组:一组类似于神经细胞黏附分子(NCAM),另一组类似于包括细胞间黏附分子-1(ICAM1) 、血管细胞黏附分子1(VCAM1) 、L1型细胞黏附分子(L1-CAM)等的细胞黏附分子。 图1阐述了这些黏附分子在癌转移中发挥的作用[ 3]。这2组细胞黏附分子在癌转移中所发挥的作用相反,其中NCAM的表达在癌症患者中从成人型120 000转变成胚胎型140 000和180 000,而且其表达还发生了下调[ 2]。一些报道表明,NCAM表达的下调和一些肿瘤的预后不良有直接的关系,在同型或异型细胞中起同源黏附功能,其高表达易导致肾癌中枢神经系统和肾上腺转移[ 5]。L1-CAM是一种具有多种免疫球蛋白结构域的细胞黏附分子,其在肾癌中的高表达与肾癌侵袭和转移高度相关[ 6]。
钙黏素家族是一种含有免疫球蛋白结构域且依赖钙离子存在而发挥作用的细胞黏附分子,能介导信号传导途径。包括经典钙黏素、桥粒钙黏素、钙黏素原及其他一些钙黏蛋白相关分子。连环蛋白可介导钙黏蛋白结合到细胞骨架上,β-连环蛋白可直接黏附在钙黏蛋白的胞质区。通过改变胞质区钙离子、G蛋白和酪氨酸激酶活性参与信号传导途径。在许多肿瘤中,E-钙黏蛋白表达下调或不表达提示肿瘤有更高的侵袭能力和不良预后[ 4]。E-钙黏蛋白-连环蛋白复合体在细胞内的分布和结合的多少都能反映肿瘤的恶性程度。钙黏素的另外一个成员N-钙黏蛋白也在肿瘤的进展和转移过程中发挥了重要作用,钙黏素高表达与许多肿瘤不良预后有关,并且N-钙黏蛋白的高表达常常伴随有E-钙黏蛋白的低表达[ 3, 7]。一些学者认为,钙黏素家族成员能够根据环境的变化改变表达谱,从而适应转移侵袭的需要,Shimazui等[ 8]研究在转移性、非转移性及肾切除后复发性肾癌远处转移的患者外周血中钙黏蛋白-6 mRNA的表达水平,结果显示,钙黏蛋白-6在转移性肾癌患者中表达率比非转移性患者显著增高,提示钙黏蛋白-6可望成为肾癌转移的一种标志物。
整合素家族是一类细胞膜表面糖蛋白受体家族分子,18 个α亚单位和8个β亚单位共同组成24 种整合素异二聚体,主要介导细胞与细胞之间及细胞与细胞外基质之间的黏附,且参与信号传导途径。整合素原型是纤维连接蛋白,大多数整合素可识别多个细胞外基质成分,其配体结合位点是RGD序列。由整合素介导的细胞基质的相互作用对于细胞生存、黏附、分化、迁移等起重要作用[ 2, 9]。整合素自身没有特异性蛋白激酶所需要的一些连接分子,如整合素连接激酶(ILK)和黏着斑激酶(FAK)[ 9]。整合素在肿瘤转移中使肿瘤细胞同质性黏附下降、异质性黏附增加,进而使肿瘤细胞侵袭转移增强,其对不同种细胞间的黏附能力的影响不同,且可与基质金属蛋白酶(MMP)结合并正向调控MMP 的表达,MMP 的高表达可直接破坏和降解细胞外基质,从而为肿瘤细胞的转移做了充分的准备[ 10, 11] 。
选择素家族是一种跨膜C型外源凝集素,与其配体表达的碳水化合物结合,已发现的P-选择素、E-选择素、L-选择素彼此结构非常相似,且表达于粒细胞、内皮细胞及血小板。选择素首先介导异型白细胞黏附到内皮细胞及血小板上,继而激活β2-整合素,使白细胞黏附到血管壁[ 3]。3种选择素都包含一个胞质区尾,这种胞质区尾在进行性肿瘤中充当信号受体的作用,E-选择素是整合素介导的细胞黏附分子的配体,其调节白细胞或肿瘤细胞与内皮细胞的黏附。E-选择素可促进血管内肿瘤细胞与内皮细胞的黏附,进而提高癌细胞的转移潜能[ 12]。
其他一些受体家族包括尚未归类的多配体聚糖、CD44等,他们是一种多功能的细胞表面跨膜糖蛋白,主要与细胞外基质中透明质酸、胶原蛋白、层黏连蛋白、纤维连接蛋白等结合,参与细胞和基质的黏附。多配体聚糖是一种包含细胞表面硫酸类肝素的蛋白多糖,这种含有硫酸乙酰肝素的侧链能够与配体结合。多配体聚糖-2是多配体聚糖中的一种,其核心蛋白分成3个区:N端胞外区、单个跨膜区和胞质区尾[ 2]。CD44是与肿瘤转移有关的受体之一,其分布极为广泛。已知有v1~v9共9种变异分子,其差异主要在序列的中间部分[ 13]。有研究表明,CD44v6、CD44v9 与肿瘤的侵袭和转移密切相关[ 14]。
细胞黏附分子在肿瘤侵袭转移中是直接或间接相互作用的。前已述及整合素和CD44同时具有IgSF和细胞外基质的结合位点,这说明IgSF成员可和整合素及CD44结合,而其与选择素及钙黏蛋白之间的相互作用也有报道。同时,有些选择素可作为整合素的配体,而钙黏素与整合素及多配体聚糖在联合调控中起重要作用[ 2, 3, 15]。多配体聚糖-1、多配体聚糖-2和多配体聚糖-4的外功能区能够促进整合素调节细胞黏附作用[ 16]。
体内外实验证实,MMP-2对鼠肾癌细胞Renca及裸鼠肾癌侵袭转移起着非常重要的作用,其表达量增高大大促进了肾癌侵袭转移潜能;与此同时,MMP-2与金属蛋白酶组织抑制物2(TIMP2)的表达比例失调是肾癌细胞株Renca侵袭转移的重要因素[ 17]。肾癌中MMP-9表达增高是肾癌不良预后性变量[ 18]。而侵袭抑制因子nm23H1在肾癌中的低表达可能由表达量过高的MMP-2所介导[ 19]。因此,MMP除自身具有降解基质的功能外,还可抑制侵袭抑制因子nm23H1的表达,大大促进了癌细胞侵袭转移的能力。在肾癌侵袭转移中上皮细胞钙黏蛋白可降低肾癌侵袭转移的能力,而MMP与之相反,MMP/E-钙黏蛋白的比例可以作为肾癌预后的独立危险因素,二者都与肾癌侵袭转移能力密切相关[ 20]。因此,他们作用机制可能为E-钙黏蛋白下调 MMP,继而下调 nm23H1。视网膜母细胞瘤基因(VHL)、缺氧诱导因子-1α(HIF-1α)及血管内皮细胞生长因子(VEGF)已经被作为治疗肾癌的靶分子[ 21, 22],而细胞黏附分子调控肾癌侵袭转移的机制多数与这些因子有关。RCC4细胞中VHL可上调上皮细胞钙黏蛋白mRNA,而下调HIF-1α在肾癌细胞中的表达,E-钙黏蛋白与组织抑制因子-1α存在负相关,但VHL上调上皮细胞钙黏蛋白 mRNA关系在786-0细胞株中尚未得到证实[ 23]。因此,对于E-钙黏蛋白、HIF-1α及 VHL之间的关系仍需进行大量实验研究。多配体聚糖-2可抑制MMP-2活性使得癌转移受抑制[ 24]。由此可见,肾癌侵袭转移中细胞黏附分子的作用基本上都与MMP有关。肿瘤侵袭转移有3个基本特征:(1) 细胞从周围组织脱离,这通常与E-钙黏蛋白 或NCAM有关;(2) 上调迁移的细胞黏附分子,如N-钙黏蛋白、L1-CAM、CD44及MMP降解细胞外基质;(3) 由整合素、选择素、CD44及免疫球蛋白的一些成员介导的肿瘤细胞播散。其作用见 图1。
综上所述,细胞黏附分子广泛表达于肾癌中,且在肾癌侵袭转移过程中起非常重要的作用,而细胞黏附分子在转移性肾癌中表达量的高低与转移潜能关系重大,上调或下调细胞黏附分子在肾癌中的表达将会影响癌细胞的侵袭转移活性。因此,细胞黏附分子可望成为肾癌侵袭转移的新的分子标志物和治疗靶点。各种细胞黏附分子在肿瘤侵袭转移过程中是相互作用的,且在肾癌侵袭转移中作用机制大多与MMP有关,但其作用机制尚未十分明确。有些报道前后并不一致,如NCAM一向被认为具有抗侵袭转移活性[ 3],而在近几年的研究中又被认为具有促进癌细胞侵袭转移的活性[ 5];与此相反,多配体聚糖-2以前被认为具有促进癌细胞侵袭转移能力[ 2],最近又被证明具有抑制侵袭转移活性[ 24],这可能与癌的种类及癌细胞株不同有关。因此细胞黏附分子在肿瘤侵袭转移中的作用是一复杂的过程,其机制有待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|