作者简介:陈松劲,男,1968年生,学士,副主任技师,主要从事临床生化和免疫学检验及实验室管理工作。
新蝶呤是体内三磷酸鸟苷(GTP)和四氢生物蝶呤生物合成途径中的中间产物之一, 也是苯丙氨酸、酪氨酸及色氨酸羟化过程中的辅酶。化学名为2-胺基-4-羟基-6-(D-赤藓糖基-1, 2, 3-三羟基丙基)蝶呤, 是一种低相对分子质量的碱性物质, 由GTP经GTP-环水解酶I合成。目前仅在人类和灵长类检测到新蝶呤, 其生物稳定性较好。目前对新蝶呤的研究, 已经涉及到与细胞免疫反应激活相关的各类疾病, 包括感染、创伤、肿瘤、自身免疫和其他炎症性疾病。也应用于对疾病进程的预计、预后的评估, 如恶性疾病和人类免疫缺陷病素(HIV)引起的感染。还有助于辅助诊断鉴别伴有或无细胞免疫参与的疾病, 可作为急性冠状动脉综合征(ACS)患者发生心脏事件的预告因子[1]。
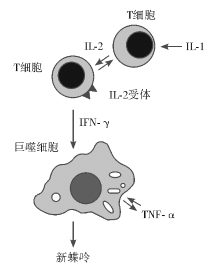
新蝶呤在体内主要是由单核巨噬细胞产生的内源性物质, 可由被刺激的T细胞所分泌的γ -干扰素(IFN-γ )刺激外周血单核巨噬细胞系统产生。肿瘤坏死因子α (TNF-α )、白细胞介素-1(IL-1)、白细胞介素-2(IL-2)和IL-2受体也参与了新蝶呤的生成过程。患者体内新蝶呤浓度升高与细胞免疫反应失衡有关, 其产生机理见图1。脂多糖和TNF-α 能增强IFN-γ 刺激新蝶呤释放的作用。在患者体内IL-1、IL-2等细胞因子可诱导T细胞释放IFN-γ , 从而刺激新蝶呤生成, 而单核巨噬细胞集落刺激因子 (granulocytemacrophage colony stimulating factor, GM-CSF)可以通过提高单核巨噬细胞数量使新蝶呤水平增高。随着新蝶呤测定方法的不断简化和完善, 使临床应用日益广泛, 新蝶呤作为IFN-γ 诱导单核巨噬细胞活性增强的一个特异性标志物[2], 是细胞介导免疫激活的象征。
1. 高效液相色谱法[3] 血清样本经三氯乙酸去蛋白, 低温高速离心, 用碱中和后直接进样, 荧光激发波长为360 nm, 发射波长为440 nm, 流动相为甲醇-水。线性范围可达800 μ g/L, 检测灵敏度为0.01 μ g/L, 精密度为2.87%~6.57%, 回收率为97.9%~108.0%。该法分析速度快, 分离效果好, 有较好的精密度和准确度。但是, 此法需要高效液相色谱仪等设备, 且样本需要预处理, 也不适合批量样本的测定, 故临床应用受到一定限制。
2.酶联免疫吸附试验[4] 通过新蝶呤与蛋白质交联后免疫Balb/c鼠, 筛选出抗新蝶呤的单克隆抗体, 采用此单抗建立酶联免疫吸附竞争抑制法测定新蝶呤, 批内精密度为3.63%, 批间精密度为9.17%。该法操作简便, 方法灵敏, 重复性好, 适合于大批量样本的操作。且目前国外有商品试剂供应, 为新蝶呤测定的临床应用提供了条件。
1.多重创伤与脓毒症 在多重创伤或手术的患者中, 血清新蝶呤浓度升高是即将发生脓毒症的一个指标。脓毒症是严重创伤、术后和感染的常见并发症, 进一步发展可导致脓毒性休克、多脏器功能不全综合征(MODS), 是危重患者死亡的重要原因之一。崔巍等[5]测定了60例包括多发伤、脑外伤等危重患者的血清新蝶呤水平, 结果显示患者组新蝶呤水平显著高于正常对照组, 且脓毒症患者显著高于非脓毒症患者; 在脓毒症患者中, 发生MODS者血清新喋呤水平显著高于未发生MODS者, 但MODS发展至终末阶段时的新蝶呤水平显著低于MODS起始期。以新蝶呤> 10 μ g/L为判断限, 诊断MODS的敏感性、特异性和准确度分别为72.4%(21/29)、88.0%(66/75)和83.7%(87/104), 阳性预测值、阴性预测值分别为70.0%(21/30)和89.2%(66/74)。动态检测新蝶呤水平有助于早期协助诊断脓毒症及MODS、判断严重程度及预后, 对尽早采取有效措施, 提高危重患者的救治率有重要意义。
2.病毒感染 在病毒感染时通常新蝶呤浓度先于首次症状和在能检测到的抗体合成之前即开始升高。例如在乙型肝炎病毒感染的患者中, 慢性重型肝炎组血清新蝶呤水平明显高于肝炎肝硬化组和慢性肝炎组; 慢性乙型肝炎患者血清新蝶呤水平明显高于健康对照组, 且乙型肝炎病毒e抗原阳性组患者新蝶呤水平明显高于乙型肝炎病毒e抗原阴性组[6, 7]。目前认为乙型肝炎是一种免疫相关性疾病, 肝细胞炎症和损伤是由于病毒的复制和抗原表达所激发的机体免疫病理所致, 新蝶呤的检测有助于了解乙型肝炎患者机体的免疫应答状态及其免疫学发展进程。新蝶呤的测定也可作为严重急性呼吸综合征(SARS)严重程度的早期指征之一[8], 利用新蝶呤来估计SARS的严重程度, 使患者得到合适的早期治疗方案, 可获得较好的治疗效果。
3.寄生虫和胞内菌引起的感染 在细胞内细菌和寄生虫有关的感染中新蝶呤浓度可升高, 几乎所有急性疟疾患者中新蝶呤均增高; 肺结核患者中也增高, 且新蝶呤消除的程度与疾病的范围和严重程度密切相关。
4.类风湿关节炎(RA) 是一种常见的累及周围关节为主的多系统的自身免疫性疾病, 细胞因子的异常产生和相互作用在RA患者的软骨和骨质破坏中起重要作用, 新蝶呤是一种细胞介导免疫激发的敏感指标, 能反映T细胞和巨噬细胞激活状态。张颖等[9]测定了30例活动性RA的细胞因子和新蝶呤水平, 结果显示RA患者细胞因子和新蝶呤水平显著高于对照组, 但新蝶呤水平与RA活动性不相关。表明RA患者巨噬细胞活动性增强, 细胞免疫功能亢进, 通常RA患者在临床症状出现之前新蝶呤水平升高, 尤其在急性期。通过测定关节滑膜液中新蝶呤水平会比血清更有意义, 新蝶呤也是RA早期诊断的指标, 一般新蝶呤在RA的Ⅰ 期就可升高, 而临床常用的类风湿因子一般在RA的Ⅱ 期才出现阳性。
5.系统性红斑狼疮(SLE) 是典型的全身性自身免疫性疾病。在免疫学上最突出的表现是B细胞功能亢进伴自发产生大量多克隆免疫球蛋白和自身抗体, 而B细胞功能的亢进受T细胞的调节, SLE患者T细胞功能存在多种异常, T细胞功能的活跃与SLE的发病机理有密切的关系。SLE患者T细胞的细胞凋亡紊乱, CD4+细胞功能活跃, 产生大量的IFN-γ , 刺激单核细胞、巨噬细胞合成大量新蝶呤。王兰兰等[10]测定了60例SLE患者的新蝶呤水平, 结果表明SLE患者血清新蝶呤水平明显升高, 且活动期高于非活动期。通过对SLE患者新蝶呤的测定进一步证实了SLE患者存在细胞免疫的异常活跃, SLE活动期与非活动期的免疫紊乱的程度有差异。多元分析表明新蝶呤与红细胞沉降率联合为最好的评估SLE患者疾病活动度的指标。
6.皮肌炎等其他自身免疫性疾病 在皮肌炎患者中新蝶呤水平明显升高, 提示皮肌炎患者有T细胞介导的免疫反应的激活[4]。在多发性硬化病, 患者脑脊液中新蝶呤的浓度在疾病恶化期显著高于稳定期。活动期肺肉样瘤患者在晚期新蝶呤浓度升高, 新蝶呤浓度下降可视为临床改善和疾病好转。另外, 在节段性回肠炎、溃疡性结肠炎等胃肠道疾病中, 新蝶呤水平与疾病的活动密切相关。因此, 新蝶呤的测定能反映细胞免疫的激活状态, 进而用于检测疾病的活动, 在治疗效果及预示疾病复发方面也有一定意义。自身免疫性疾病是机体对自身成分发生免疫应答而导致的疾病状态。自身抗体和(或)自身反应性T细胞介导的对自身成分发生的获得性免疫应答, 是自身免疫性疾病发生的原因, 测定自身免疫失调患者中新蝶呤的浓度, 能敏感和可靠地反映出疾病的活动性和严重性。
7.肿瘤 肿瘤细胞的代谢增强, 退化的恶性细胞激活T细胞导致产生细胞因子, 激活单核巨噬细胞系统, 巨噬细胞活化时在T细胞分泌的内源性IFN-γ 诱导下大量释放新蝶呤。而高新蝶呤水平往往提示肿瘤进展及预示不佳, 此可能与肿瘤细胞鸟苷酸的合成增加导致GTP增加有关。GTP是合成新蝶呤的基本原料, 酶促作用上调, 致新蝶呤的合成增多。新蝶呤水平在胃癌、血液系统恶性肿瘤、卵巢癌、结肠癌、肺癌等恶性肿瘤中均可升高, 新蝶呤水平对肿瘤的诊断价值有限, 但在肿瘤的分期及预后判断方面更有意义。昂健等[11]测定了63例胃癌患者的新蝶呤水平, 结果显示胃癌患者显著高于胃炎和对照组, TNM分期Ⅰ 、Ⅱ 、Ⅲ 、Ⅳ 期的新蝶呤水平依次递增, 不同TNM分期胃癌患者血清新蝶呤水平差异有显著意义, 且新喋呤水平与胃癌分期相关(r=0.969, P< 0.001)。在肺癌患者中, 不同病期、不同病理类型的患者血清新蝶呤水平无差异, 但可作为判断肺癌患者细胞免疫功能的一个客观指标[12]。
8.心血管疾病 ACS是临床常见的因急性心肌缺血引起的一个连续的疾病谱, 包括不稳定型心绞痛(UAP)、非ST段抬高型心肌梗死(NSTEMI)及ST段抬高型心肌梗死(STEMI)。其共同的病理基础与冠状动脉粥样硬化斑块破裂及伴随的血小板聚集, 血栓形成导致的急性、亚急性心肌缺血有关。研究发现, 冠状动脉不稳定斑块及斑块破裂处有大量单核巨噬细胞及T细胞的浸润和激活。通过测定血液中的新蝶呤浓度可以在心肌细胞损伤前早期筛选出存在冠状动脉不稳定斑块的高危患者。Schumacher等[13]测定了急性心肌梗死(AMI)、稳定型心绞痛(SAP)患者的新蝶呤水平, 结果显示AMI患者新蝶呤水平显著高于SAP及对照组, SAP组新蝶呤水平也显著高于对照组。金哲秀等[14]通过观察ACS和SAP患者的新蝶呤浓度变化, 探讨了血清新蝶呤与冠状动脉病变活动之间的相关性, 结果表明ACS组的新蝶呤浓度显著高于SAP组和对照组(P< 0.0001), ACS亚组中AMI与UAP之间也有差异(P< 0.05), 且ACS组的血清新蝶呤浓度与活动的动脉粥样硬化斑块的数量有明显的相关性(r=0.444, P< 0.001)。上述结果提示, 单核巨噬细胞系统的激活在冠心病发病中发挥重要作用。AMI时往往存在炎性递质诱导下的斑块破裂, 破裂斑块又可进一步吸附激活单核巨噬细胞等, 从而导致新蝶呤等炎性标志物的大量释放, 新蝶呤浓度的升高也许是冠状动脉病变活动的独立预测因子, 其作为巨噬细胞活化的标志物, 能更直接的反映免疫系统活化状态[15], 同时可能表达斑块的不稳定性。通过研究新蝶呤在冠心病的表达水平, 有利于进一步了解动脉粥样硬化的形成和不稳定斑块破裂的机制, 为识别不稳定斑块、预测ACS发生的危险性提供有效、简便的客观指标[16]。
9.器官移植和免疫调节治疗的监测 在实体器官(肾, 肝, 胰腺, 心脏)同种移植的受者测定新蝶呤水平是一个早期识别免疫并发症如移植排斥或病毒感染的敏感参数。一般新蝶呤水平平均于临床并发症出现前2 d上升。骨髓移植的患者骨髓再生不良与降低的新蝶呤水平有关, 在造血再构造产生前平均第7天, 新蝶呤水平就可升高。
在用细胞因子(如干扰素、白细胞介素和TNF-α )治疗期间, 患者呈现新蝶呤合成的剂量依赖刺激作用, 所以通过监测新蝶呤的浓度变化可用于最有效地进行免疫调节治疗。
综上所述, 新蝶呤浓度的上升显示细胞免疫系统的激活, 新蝶呤水平不仅反映在单个细胞因子上, 而且可以评价免疫系统对单核巨噬细胞的累积影响。新蝶呤生物稳定性好, 随着简便、可靠的酶联免疫吸附试验测定新蝶呤方法的日益普及, 新蝶呤的临床应用越来越广泛, 除了包括免疫系统激活外, 还可在罕见的生物蝶呤合成障碍中观察到, 即在非典型性苯丙酮尿症中被用作鉴别诊断。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|