作者简介:张军力,女,1956年生,学士,主任技师,主要从事分子生物学和生物化学检验工作。
探讨不同液化方法对痰液中DNA提取的影响。
方法应用4种不同的痰液液化方法处理痰液,即1 mol/L氢氧化钠振摇液化;1 mol/L氢氧化钠80 ℃消化;Saccomanno法和二硫苏糖醇(DTT)法联合应用;0.5% N-乙酸-L半胱氨酸、1.45%枸橼酸钠和2%氢氧化钠的液化剂振摇液化。对经4种方法处理的痰液分别提取DNA,应用分光光度仪测量波长为260和280 nm处的吸光度( A),计算DNA浓度。
结果用Saccomanno法和DTT法联合应用于痰液液化,其DNA提取效果优于其他3种方法。
结论本研究为痰液作为呼吸系统疾病分子诊断标本提供了前期处理的依据。
结核病的细菌学检测在结核病防治工作中起着非常重要的作用[1]。由于结核分枝杆菌生长时间较长, 影响因素较多, 使得结核病的诊断发展较慢。但随着分子生物学的迅猛发展, 结核分子生物学检测技术以其快速、敏感、特异等优点, 提高了结核病的诊断率。对痰液中结核分枝杆菌的检查有多种方法, 其中聚合酶链反应(PCR)为呼吸系统感染性疾病的诊断提供了一条新途径[2, 3]。PCR检测结核分枝杆菌DNA成败关键在于DNA提取。痰液中有大量黏液, 使其中的细胞成分不易分离, 高纯度及较大量的DNA提取存在着一定困难。我们采用了4种不同的痰液液化方法, 对痰液中的DNA进行提取, 并对DNA的纯度及浓度进行对比研究, 拟对临床痰液标本的最适处理方法做一优化选择。
收集内蒙古医学院附属医院2007年4月至8月痰涂片抗酸染色阳性的痰液标本30例。
1. 4种不同的液化方法 方法1:500 μ L痰液加入5 mL 1 mol/L氢氧化钠, 振摇液化30 min后, 14 000 r/min(离心半径为6.8 cm)离心5 min, 沉淀用1.5 mL去离子水洗, 12 000 r/min(离心半径为6.8 cm)离心5 min, 留沉淀待用; 方法2:痰液中加入4倍体积的1 mol/L 氢氧化钠, 混合液化30 min, 80 ℃消化30 min, 取1.5 mL于离心管, 12 000 r/min(离心半径为6.8 cm)离心5 min, 沉淀用三羟甲基氨基甲烷-盐酸(Tris-HCl)和乙二胺四乙酸(EDTA)缓冲液洗3次, 12 000 r/min(离心半径为6.8 cm)离心5 min, 取沉淀待用; 方法3:Saccomanno液(每50毫升固定液中含50%乙醇48 mL, 2%聚乙二醇1 mL、0.3%利福平1 mL)、 二硫苏糖醇(DTT)液(0.1 g DTT、0.78 g氯化钠、0.02 g氯化钾、0.112 g磷酸二氢钠、0.02 g磷酸二氢钾, 加水至2 L, 使DTT浓度为0.005%[4])等体积混合, 1~2倍体积加入到痰液中, 振摇液化30 min; 方法4:痰液用1~2倍体积液化剂(0.5%N-乙酸-L半胱氨酸, 1.45%枸橼酸钠, 2%氢氧化钠)振摇液化30 min。
2. 痰液中DNA提取 根据参考文献[5], 采用经典的酚-氯仿抽提的方法。加等体积氯仿:异戊醇(24:1)混匀, 8 000 r/min(离心半径为6.8 cm)离心10 min, 转移上层水相, 加2倍体积无水乙醇和1/10体积3 mol/L醋酸钠, 混匀, -20 ℃ 60 min后, 12 000 r/min(离心半径为6.8 cm)离心15 min, 以70%乙醇洗涤1~2次, 室温稍干燥后加入100 μ L Tris-HCl和EDTA缓冲液, 溶解DNA。
3. 吸光度(A)检测 应用Beckman Coulter DU800型核酸蛋白分析仪检测波长为260和280 nm处的A。
所有数据以
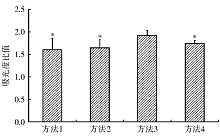
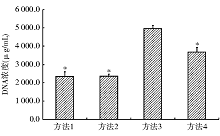
方法3即Saccomanno法和DTT法联合应用液化痰液提取的DNA其260与280 nm波长处A比值为1.919± 0.115, 与方法1、方法2、方法4(分别为1.603± 0.259、1.647± 0.177、1.743± 0.065)比较, 差异具有统计学意义(P< 0.05); 方法3液化后提取的DNA浓度为(4 963.060± 167.398)μ g/mL, 与方法1、方法2以及方法4[分别为(2 347.057± 260.861)μ g/mL、(2 368.325± 113.466)μ g/mL、(3 678.350± 259.315)μ g/mL]比较明显增多, 差异具有统计学意义(P< 0.05)。不同液化方法提取DNA A的比值和浓度结果见图1、2及表1。
| 表1 不同的液化方法所提取DNA 260 nm波长处与280 nm波长处A比值(30例) |
Saccomanno法是1963年由Saccomanno建立的一种经典的痰液固定方法, 其主要作用是固定痰液中脱落细胞的形态, 使细胞膜不致于破裂, 防止细胞崩解, 以利于进行脱落细胞学检查, 严格地讲其对痰液并无液化作用。DTT法由桥木等人首先应用, 众多资料表明, 其对痰液的液化效果较好[5, 6], 其作用机制是破坏黏液中的二硫链, 使蛋白质分解破坏。单纯应用DTT液化黏液, 其效果不好, 可能是由于二硫键侧链破坏的同时, 其分子内部或分子间的关系亦发生改变, 黏液就可能迅速地从溶液状态转变为凝胶状态, 从而部分地抵消了DTT的溶解液化作用。另外痰液中的细菌及外界环境亦可能使黏蛋白分子内部或分子间结构改变, 从而导致了痰液向凝胶状态的转化。而应用DTT液的同时应用Saccomanno固定液解决了这种缺陷, 因为该固定液具有很好的固定作用, 能稳定分子间的关系, 从而减少了痰液向凝胶状态的转化, 达到很好的液化效果。
痰液DNA的提取与组织提取方法基本相同, 液化效果差的痰液在离心时有大量的黏液沉淀于离心管底部, 痰液中的细胞成分浮在其上或与其混合, 对DNA的提取造成了一些困难。首先, 黏液量大, 细胞相对分散, 要分多次提取DNA, 痰液中细胞成分本来就有限, 分次提取后, DNA量均较少, 有的甚至没有。其次, 由于大量黏液存在, 必须抽提多次, 若抽提次数少, 蛋白质就混入核酸中, 使DNA不纯; 若抽提次数多, 会造成DNA的丢失, 这都为以后的分析检测带来一定的难度。另外, 黏液的存在给操作带来了很大的麻烦, 多次DNA提取需要消耗大量的试剂, 特别是蛋白酶K, 同时多次DNA提取还会浪费大量的时间和精力。采用Saccomanno法和DTT法联合应用时, 黏液几乎完全液化, 离心痰液时, 沉积于离心管底部的只有细胞成分及少量杂质。细胞成分的充分集中, 有利于DNA的提取, 其方法比组织DNA提取还简单, 所得DNA的纯度及量均较满意。另外Saccomanno法有稳定细胞结构的作用, 使得DNA的完整性得以保存。结核分枝杆菌细胞壁较厚、脂类含量高, 同时临床标本中组成成分复杂。方法3不仅能很好地液化标本, 而且对细胞壁的裂解有促进作用; 采用酚-氯仿-异戊醇抽提, 乙醇沉淀DNA, 可去除TaqDNA聚合酶抑制剂, 有利于目的片段的扩增[7]。
本研究应用260 nm波长处与280 nm波长处A的比值作为DNA纯度的指标, 一般来说, 高纯度DNA该比值为2, 作为分析用DNA其比值应在1.7以上为好, < 1.6则效果较差[8]。本实验应用方法3液化痰液后, 提取DNA的A比值基本上都> 1.6。另有4例< 1.6的标本可能是由于所留取的痰液本来就少, 或痰液中的细胞成分本来就少所致。通过对4种方法的比较, 我们认为Saccomanno法和DTT法的联合应用, 对痰液的固定液化效果较好, 有利于痰液DNA的提取, 为痰液在呼吸系统疾病分子诊断中的应用提供了依据。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|