作者简介:沈小明,男,1975年生,学士,主管技师,主要从事微生物学检验工作。
探索一种快速、敏感、特异的空肠弯曲菌检验方法。
方法根据GenBank公布的空肠弯曲菌基因序列,在其保守区域设计特异性引物与探针以建立基于TaqMan探针的实时荧光聚合酶链反应(PCR)方法,并对方法的特异性、敏感性和重复性进行研究。
结果该方法对空肠弯曲菌可产生特异扩增信号,对其他非空肠弯曲菌菌属无响应,其检测敏感性可达10cfu/mL。反应体系具有很高的稳定性。
结论实时荧光PCR可快速、特异、灵敏地检测空肠弯曲菌,具有较强的实际应用价值。
To explore a rapid, sensitivety and specific method for examining Campylobacter jejuni ( C. jejuni) .
MethodsAccording to C. jejuni sequences from Ganbank, the specific primers and probe were designed on the basis of conserved gene region and a TaqMan real-time fluorescent polymerase chain reaction (PCR) was established. The specificity, sensitivity and repeatability of the assay were also studied.
ResultsC. jejuni was amplified by real - time fluorescent PCR successfully while all non- C. jejuni bacterial species did not generate any signal. The assay had high sensitivity and repeatability, and the low detecting limit was 10 cfu /mL.
ConclusionsThe real-time fluorescent PCR is a rapid, specific and sensitive method for qua.pngying C. jejuni, thus it has high practical value of application.
空肠弯曲菌 (campylobacter jejuni, C. jejuni) 属微需氧革兰阴性鞭毛螺旋菌, 是一种重要的人兽共患病病原体。许多家禽家畜和野生动物都为该菌宿主, 人类主要通过饮用被污染的水源、乳制品及食物或与动物直接接触而感染[1]。自1972年Dekeyser首次从腹泻患者粪便中成功分离空肠弯曲菌以来, 该菌引起的感染性腹泻在世界各地普遍呈上升趋势。在发展中国家, 该菌是婴幼儿感染性腹泻最常见的病原菌; 在一些发达国家, 该菌作为急性腹泻的病因甚至超过了沙门菌与志贺菌 [2]。除引起急性腹泻外, 空肠弯曲菌感染还可伴发反应性关节炎、赖特综合征(Reiter's syndrome)和吉兰-巴雷综合征(Guillian-Barré syndrome, GBS)等免疫损伤性疾病[3, 4]。它已被世界卫生组织(WHO)列为新的食源性传染病, 是许多国家食品卫生检验的法定检测项目。我国也于2003年将其列为“ 全国食品污染物监测网” 重点监测内容[5]。
建立空肠弯曲菌的快速而特异的分离检测方法, 对于有效预防和控制该类正在发展的食源性病原菌具有重要的流行病学意义和临床应用价值。然而传统的细菌分离鉴定方法需要耗费大量的时间和人力, 且存在培养条件苛刻(需5%O2、10%CO2、85%N2微需氧环境)、常规生化鉴定繁琐、检测敏感性低等问题, 已越来越不能满足现在日益发展的公共卫生检测要求。而实时荧光聚合酶链反应(PCR)技术因高敏感、高特异、高精确度、高通量和全封闭反应等优点已逐渐成为一种新的鉴定细菌的方法。
本研究利用目前最常用的TaqMan 探针法来建立空肠弯曲菌的实时荧光PCR检测方法, 以期快速、敏感、特异地检测空肠弯曲菌。
1. 菌株 空肠弯曲菌标准株(ATCC 33560)、金黄色葡萄球菌(ATCC 25923)、大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、猪霍乱沙门菌(ATCC 14028)、蜡样芽孢杆菌(CMCC 63303)、霍乱弧菌、副溶血性弧菌、结肠弯曲菌、单核细胞增生李斯特菌、痢疾志贺菌、福氏志贺菌、宋内志贺菌、伤寒沙门菌、甲型副伤寒沙门菌、嗜水气单胞菌。
2. 主要培养基和试剂 布氏肉汤、改良Camp-BAP培养基购自中国腹泻病控制上海试剂供应研究中心。哥伦比亚血平板购自郑州博赛生物工程有限公司。微需氧产气袋、厌氧培养盒、API Campy(Biomerieux)试剂盒购自法国生物梅里埃公司。DNA提取试剂、DNA 聚合酶、dNTPs( dUTP 取代dTTP)等购自或合成于上海生物工程技术服务有限公司。
3. 主要仪器 荧光定量PCR仪(ABI 7000, 美国)。恒温金属浴(BIOER HB-100, 日本)。高速冷冻离心机(THERMO Micromax RF, 美国)。
1.引物和TaqMan探针的设计和合成 根据GenBank上空肠弯曲菌基因组的保守序列, 用Oligo6.0和Primer Express2.0设计引物和Taqman荧光探针。探针的荧光标记选择6-羧基荧光素(FAM)作为报告发光基团, 以6-羧基四甲基若丹明(TAMRA)为淬灭基团, 引物和探针由上海生物工程技术服务有限公司合成。
上游引物: 5' TAAGGGCCATGATGACTT 3'
下游引物: 5' CCGAGCACTCTAAATAGAC 3'
Taqman荧光探针: 5' (FAM)CGTCCACACC-TTCCTCCTCC(TAMRA) 3'
2.常规培养法 按《食品卫生微生物学检验(GB 4789.9— 2003)》和《感染性腹泻的诊断标准及处理原则(GB 17012— 1997)》进行操作。
3.模板DNA的提取 (1)菌悬液DNA提取:取样品菌悬液1.0 mL于1.5 mL离心管中, 11 300 r/min(离心半径8.3 cm)离心10 min, 弃上清液, 加DNA提取液50μ L入沉淀中, 振荡混匀。恒温金属浴100 ℃ 10 min后11 300 r/min(离心半径8.3 cm)离心3 min, 取上清液; (2)粪便标本预处理及DNA提取:参照文献方法[6], 在1g粪便标本中加入9 mL 0.85%无菌生理盐水, 充分混匀成粪便匀浆, 然后300 g低速离心10 min收集上清液。此步骤重复2次。然后上清液8 700 r/min(离心半径8.3 cm)离心10 min, 收集沉淀于1.5 mL Eppendorf微量离心管中, 加入0.8mL双蒸水充分混匀, 13 100 r/min(离心半径8.3 cm)离心5 min。弃上清液, 加DNA提取液50 μ L入沉淀中, 振荡混匀。恒温金属浴100 ℃10 min后4 ℃11 300 r/min(离心半径8.3 cm)离心3 min, 取上清液。
4.实时荧光PCR扩增 实时荧光PCR反应体系为24 μ L(4.5 mmol/L MgCl2, 0.2 mmol/L的脱氧腺苷三磷酸(dATP), 0.2 mmol/L脱氧鸟苷三磷酸(dGTP), 0.2 mmol/L脱氧胞苷三磷酸(dCTP), 0.4 mmol/L脱氧尿嘧啶三磷酸(dUTP), 上游下游引物各20 pmol, TaqMan 探针10 pmol, 20 mmol/L Tris-HCl, 50 mmol/L KCl, 0.5%曲拉通X-100(TritonX-100), 5%(v/v)甘油, 1.5 U Taq酶, 0.1 U尿嘧啶N糖基化酶(UNG), 3μ L DNA模板)。
PCR反应条件为:预热50 ℃ 2 min , 95 ℃ 10 min, 接着40个循环(94 ℃ 10 s和60 ℃ 40 s)。整个反应过程中荧光信号的变化由ABI 7000实时荧光定量PCR仪监测。
质量控制和结果判断:样本的循环阈值Ct(cycle threshold)≤ 35者判为阳性; 样本的Ct值等于0或者40者判为阴性; 样本的Ct值介于35~40之间, 则该份样本应重新实验, 如果重新实验Ct值仍< 40, 但曲线有明显的对数增长特性, 判为阳性, 否则判为阴性。所有样本检测实验均应包含阳性对照和试剂空白对照。
5.实时荧光PCR特异性实验 对空肠弯曲菌标准菌株(ATCC 33560) 和15种易引起食源性疾病或食物中毒的非空肠弯曲菌菌株[包括金黄色葡萄球菌(ATCC 25923)、铜绿假单胞菌(ATCC 27853)、猪霍乱沙门菌(ATCC 14028)、大肠埃希菌(ATCC 25922) 、蜡样芽孢杆菌(CMCC 63303)、霍乱弧菌、副溶血性弧菌、结肠弯曲菌、单核细胞增生李斯特菌、痢疾志贺菌、福氏志贺菌、宋内志贺菌、伤寒沙门菌、甲型副伤寒沙门菌、嗜水气单胞菌] 抽提基因组DNA作为实时荧光PCR反应的模板, 同时用无菌双蒸水作为空白对照。
6.实时荧光PCR敏感性实验 将空肠弯曲菌标准菌株纯培养48 h后, 培养液11 300 r/min(离心半径8.3 cm)离心10 min , 3 倍体积灭菌生理盐水洗涤后以108 cfu/mL密度重悬于其中。然后10倍递增稀释作为标准样品用于实时荧光PCR检测, 以确定方法的敏感性。
7.实时荧光PCR的重复性 取106、105、104、103、102、101 cfu/mL 6个浓度的空肠弯曲菌基因组DNA, 每个浓度重复3次做实时荧光PCR检测, 计算Ct值的标准差(S)和变异系数(CV)来检验本法的重复性。
8.模拟污染样本的检测 (1)模拟食品污染样本:在1 g经检定为弯曲菌阴性的鸡肉样本中加入9 mL生理盐水制成鸡肉匀浆。取已标定浓度的空肠弯曲菌标准株系列稀释菌液100 μ L, 分别加至900 μ L鸡肉匀浆中制成人工染菌量为106 cfu/mL到100 cfu/mL的模拟食品污染样本。然后1 800 r/min(离心半径8.3 cm)离心10 min, 取上清液提取DNA用于实时荧光PCR检测; (2)模拟腹泻样本:在1 g检定为弯曲菌阴性的粪便样本中加入9 mL生理盐水制成粪便匀浆。取已标定浓度的空肠弯曲菌标准株系列稀释菌液100 μ L, 分别加至900 μ L粪便匀浆中制成人工染菌量为106 cfu/mL到100 cfu/mL的模拟腹泻样本, 分别提取DNA用于实时荧光PCR检测。
9.实样检测 (1)内部比对试验:随机不定期采集100份新鲜鸡鸭粪便样本, 50份禽肉类实样样本, 4 ℃下迅速带回实验室送检。采用实时荧光PCR检测同时, 同步采用国标常规培养法加API Campy (Biomerieux)弯曲菌鉴定系统对样本进行检测, 将两者的检测结果进行比对; (2)外部比对试验:通过协作单位, 保留日常检测工作中明确鉴定由因非空肠弯曲菌引起腹泻的样本, 采用实时荧光PCR法检测, 并将检测结果与协作单位按国标方法检测所得的结果进行比对。
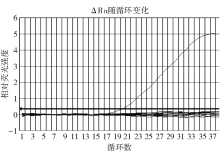
使用空肠弯曲菌特异引物及探针对空肠弯曲菌(ATCC 33560)及其他菌属的细菌进行扩增, 结果表明该引物及探针能特异扩增空肠弯曲菌, 其扩增曲线呈S形指数增长, 而其他15株非空肠弯曲菌及空白试剂对照均不能产生S形扩增曲线, 表明该实时荧光PCR具有良好的特异性, 见图1。
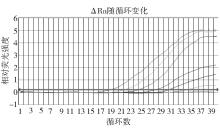
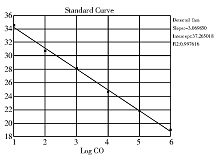
分别选取菌悬液浓度为106、105、104、103、102、101、100 cfu/mL的空肠弯曲菌基因组DNA进行定量扩增, 结果显示, 除100 cfu/mL的菌悬液没有扩增曲线外, 其他浓度均有S形扩增曲线出现, 表明该方法最低可检出10 cfu/mL的菌悬液, (见图2)。以循环阈值(Ct值)作为纵坐标, 模板细菌初始细胞数的对数为横坐标作图, 拟合得到线性相关直线, 即标准曲线(见图3), Ct值 = -3.070 Log(number of cells) +37.27, 相关系数r2为0.997 6 , 相关性良好。
取106、105、104、103、102、101 cfu/mL 6个浓度的空肠弯曲菌DNA模板, 每个浓度重复3次做实时荧光PCR检测, 并计算Ct值的S和CV来检验本法的重复性。通过反复试验表明, 该体系重复性好, 稳定性高, 结果见表1。
应用实时荧光PCR对模拟污染的食品和腹泻标本进行检验, 结果显示模拟样本空肠弯曲菌人工染菌量为102 cfu/mL以上时均有荧光信号明显增长。
| 表1 实时荧光PCR 对空肠弯曲菌检测的重复性 |
1.内部比对试验 以实时荧光PCR法, 从采集的100份鸡鸭粪便样本中检出8份阳性, 50份禽肉类中检出3份鸡肉样本阳性。阳性结果与国标常规培养法加API Campy弯曲菌鉴定系统检测结果一致。未出现假阴性和假阳性现象。
2.外部比对试验 用实时荧光PCR检测来源协作单位的100份明确由沙门菌、志贺菌等非空肠弯曲菌所引起的腹泻样本, 检测结果为空肠弯曲菌阴性, 与相关协作疾控中心用国标法检测的结果完全一致。
长期以来, 空肠弯曲菌检测主要沿袭平板分离加生化鉴定的传统鉴别方法。但是这种被称为金标准的细菌分离培养法本身存在着一些局限性:如检测周期长, 培养过程操作繁琐, 不利于现场检测与快速鉴别; 培养环境和营养条件苛刻, 在不良环境下容易进入“ 活的非可培养状态” (viable but non-culturable, VBNC)[7]; 日常培养常因选择性平板上伴有大量杂菌或目的菌落被一些增生的变形菌覆盖从而导致寻找目标菌落较困难; 传统方法中依赖的快速马尿酸水解关键生化试验已有越来越多的假阴性和假阳性存在等[8], 这些都可能是常规方法对空肠弯曲菌检出较困难的原因。而实时荧光PCR方法由于直接对空肠弯曲菌的基因组DNA进行检测, 具有敏感、特异、快速、直接的优势, 因而有效地避免了常规培养存在的这些问题。
据美国环保局报道, 大多数致病菌感染菌剂量超过103 cfu/mL 就可引起疾病发生[9], 本研究的实时荧光PCR检测敏感性高, 检出限最低可达10 cfu/mL, < 空肠弯曲菌的感染剂量。而且特异性强, 与对照组15种易引起食源性疾病或食物中毒的细菌均无交叉反应; 重复性好, CV较小; 操作简便, 结果判别直观明了。
由于实时荧光PCR技术的高敏感性特征, 从防止实验室污染的角度出发, 本方法应用了dUTP/UNG防污染系统。其反应原理[10]就是在扩增中以dUTP代替脱氧胸苷(dTTP), 扩增的PCR产物DNA 片段中均含有dUTP。下次扩增时, 若反应体系被含有dUTP 的PCR产物DNA污染, 则dUTP/UNG酶防污染系统中的UNG酶会选择性地将含有dUTP的PCR 产物DNA 磷酸骨架上的UTP 降解下来, 而对含正常胸腺嘧啶的天然样本模板DNA 无破坏作用。由于UNG酶不耐热, 可通过95 ℃热变性失活, 不影响新扩增的PCR 产物。这样既防止了含有dUTP 的PCR 产物污染, 又不妨碍目的基因的扩增, 有效地控制了假阳性的形成。同时, 我们在实验操作过程中时刻注意严格按照PCR实验操作规程分区操作, 采取尽量使用一次性耗材、实验设阳性对照和试剂空白对照等措施, 保证了实时荧光PCR结果的准确性。
实验证明, 本研究建立的实时荧光PCR检测空肠弯曲菌方法简便、易行, 从加样到检测最快可在3 h 内完成。且方法的特异性好, 敏感性高, 能够稳定地对空肠弯曲菌进行定性、定量分析检测, 在检验、检疫、疾病控制等领域将有广阔的应用前景。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|