作者简介:孙卫华,女,1973年生,硕士,助理研究员,主要从事先天性遗传代谢病的研究。
建立气相色谱质谱用技术(GC-MS)测定尿琥珀酰丙酮(SA)的方法,用于临床上鉴别诊断酪氨酸血症Ⅰ型患者。
方法尿SA先用盐酸羟胺进行污化反应,然后用乙酰乙酸2次萃取,双三甲基硅烷-三氟乙酰胺(BSTFA-TMCS)衍生化,衍生化后的SA用气相色谱质谱仪进行测定分析。质谱分析模式采用选择离子监测(SIM)模式进行检测,SA选择212/182 m/z,内标丙二酸选择233/248 m/z。分析该法的精确性、稳定性、样本回收率、残留分析和实测浓度与加入浓度之间的相关性。用该法检测肝肿大伴酪氨酸升高的13例患者。
结果SA批内变异系数( CV)为6.8%;批间 CV为7.8%;回收率为94.0%~102.0%;前处理 CV为12.4%;残留分析<1%。在5~120 mg/mL之间,实测浓度与加入浓度之间的相关系数( r)为0.997。内标丙二酸回收率为95.0%~103.0%。确诊酪氨酸血症Ⅰ型患儿2例,尿SA浓度分别为26、54 mmol/mol肌酐。
结论GC-MS测定尿SA具有较高的回收率、精确性和准确性,为临床上鉴别诊断酪氨酸血症Ⅰ型提供了新的方法。
To establish the urine succinylacetone(SA) determination by gas chromatography-mass spectrometry (GC-MS) for the differential diagnosis of tyrosinemia Ⅰ patients.
MethodsThe SA in urine was oximated by hydroxylamine hydrochloride, then extracted with ethyl acetate twice, and was derivatized with nitrogen,oxygen-bis (trimethylsilyl) trifluoroacetamide and trimethylchlorosilane (BSTFA-TMCS) and assayed by GC-MS using selected ion monitoring (SIM). The SA was determinated with 212/182 m/z and malonic acid(internal standard)with 233/248 m/z. The precision, accuracy,recoveries of the spiked samples, carry-over, linearity and the correlation of practical determination level and addition level was analyzed. Urine samples of 13 patients with hepatomegaly and tyrosinemia were determined.
ResultsThe intra and inter assay coefficient of variation ( CV) were 6.8% and 7.8%; Inter-assay CV of sequential preparations of the same sample was 12.4%.The recovery of the spiked samples were 94.0%-102.0%. The carry-over analysis was less than 1%. The correlation coefficient of linearity was 0.997. The recovery of malonic acid was 95.0%-103.0%.Two patients with tyrosinemia Ⅰ were diagnosed,and the levels of SA were 26 and 54 mmol/mol creatinine respectively.
ConclusionsThe urine SA determination by GC-MS shows high recovery, precision and accuracy. It can be used in the differential diagnosis of tyro-sinemia Ⅰ.
人体所需的酪氨酸由饮食或通过氧化苯丙氨酸获得, 除供给合成蛋白质之用外, 还是多巴胺、肾上腺素和黑色素等物质的前体。多余的酪氨酸则通过其降解途径分解为二氧化碳和水。酪氨酸血症属于氨基酸代谢紊乱疾病, 是因酪氨酸代谢过程中几种酶的缺陷所引起的先天性氨基酸代谢异常的疾病, 属常染色体隐性遗传。对婴幼儿和儿童的危害非常大, 绝大多数起病于出生后2~3个月, 大多导致死亡, 少数起病缓慢。异常蓄积的代谢产物主要累积于肝、肾等, 往往导致这些器官发生硬化、衰竭或癌变。酪氨酸血症根据其代谢途径中不同酶的缺陷可分为Ⅰ 、Ⅱ 和Ⅲ 型。酪氨酸血症Ⅰ 型又名肝肾型酪氨酸血症, 于1956年首先报道, 在这3种类型中最常见, 发病率最高[1]。酪氨酸血症在世界各地发病率不一样, 一般新生儿出生的筛查率约1/10万, 加拿大魁北克法裔人群发病率很高, 可达1/2 000[2, 3]。国内质谱技术的临床应用起步较晚, 应用不广泛, 但有报道用串联质谱技术发现7例患者[4]。酪氨酸血症Ⅰ 型是由于酪氨酸代谢途径中延胡索酰乙酰乙酸水解酶活性下降或缺失, 导致患者血中酪氨酸浓度异常升高, 和Ⅱ 、Ⅲ 型一样。但琥珀酰丙酮(succinylacetone, SA)只存在Ⅰ 型患者体液中, 只有检测患者体液中具有一定量的SA, 才可诊断为酪氨酸血症Ⅰ 型。否则, 需进行酶活性检测或基因检测。SA是公认的分析诊断酪氨酸血症Ⅰ 型的指标, 对鉴别诊断酪氨酸血症和治疗具有重要意义。由于SA常温下保存不太稳定, 体液中浓度也比较低, 一直比较难以测定。但近年来利用先进的色谱质谱技术如高效液相色谱(HPLC)、气相串联质谱(GC-MS/MS)和液相串联质谱(LC-MS/MS)来测定人体液如尿、血浆以及干血滤纸片和组织培养细胞等[5~7]。我们尝试建立采用气相色谱质谱技术(GC-MS)来测定尿液中SA的浓度。
1. 样本 收集有肝肿大、婴肝或血酪氨酸浓度升高的13例患儿的任意尿样本5~10 mL, 置无防腐剂、15 mL带盖塑料离心管或玻璃管中。样本采集后立即-20 ℃冰冻保存, 可稳定保存至少5 d。
2. 试剂 12 mol/L HCl, 10%和10 mol/LNaOH, 0.9%NaCl(分析纯, 上海凌峰化学试剂公司); 10 mg/mL肌酐(奥地利Fluka公司); 0.1 g/mL苦味酸(分析纯, 广东汕头西陇化工); 0.5 mg/mL H2O盐酸羟胺(香港Fluka公司); 乙酸乙酯(色谱纯, 美国Tedia公司), 2 mg/mL甲醇SA标准品(美国Sigma公司) ; 内标为5.25 mg/mL丙二酸(美国Sigma公司); 衍生剂为双三甲基硅烷(BSTFA):三氟乙酰胺(TMCS)=99:1(美国Supelco公司)。
3.仪器及耗材 气相色谱质谱仪(Aglient GC/MS 6890/5973i, 美国安捷伦公司); 毛细管色谱柱(HP-5MS):柱长 30 m, 直径250 μ m, 膜厚0.25 μ m(美国安捷伦公司); DB-3D吹氮仪(美国Techne公司); SHIMADZU UV-1601紫外可见分光光度计; 离心机; 微量移液器; 涡轮混合器; 高纯氦气和高纯氮气(99.999%, 上海氯闵气体有限公司)。
1. 尿肌酐(Cr)测定 采用苦味酸法测定[8], 并进行改进。(1)Cr标准曲线配制:0、0.25、0.5、0.75、1.0、1.5 mg/mL Cr标准品, 测定方法同样本测定, 绘制标准曲线; (2)Cr测定:取20 μ L尿样于10 mL玻璃离心管中, 加500 μ L 1% 苦味酸溶液, 加50 μ L 10% NaOH , 混匀, 室温静置20 min, 加2 mL H2O, 充分混匀, 分光光度计495 nm处测定。原始数据按标准曲线计算各样本Cr浓度。
2. SA提取 取相当于0.6 mg Cr的尿样(约0.3~5 mL)置于2根洁净的15 mL带盖玻璃管中(一管为测试管, 另一管为对照管), 不足5 mL用0.9% NaCl补足。2管中均加入75 μ L丙二酸(内标), 对照管中加入25 μ L SA标准品, 充分混匀。加入盐酸羟基烷胺进行污化反应。加600 μ L 10 mol/L NaOH, 调pH值至12~13。充分混匀静置1 h。加600 μ L 12 mol/L HCl, 充分混匀。每次加5 mL乙酸乙酯, 萃取2次, 每次充分混匀后4 000 r/min(离心半径为10 cm)离心8 min吸取上层有机相。高纯氮气吹干, 加入衍生剂75 μ L, 65 ℃衍生化20 min, 上机检测, 进样2 μ L。
3. GC-MS 柱温箱起始温度70 ℃ 3 min; 以10 ℃/min升温至180 ℃, 14 min; 然后再以16 ℃/min升温至270 ℃, 2 min; 进样口温度250 ℃; 氦气总流速69.2 mL/min, 不分流; 离子源温度280 ℃, 检测范围50~550 m/z。质谱检测采用高分辨率选择离子监测(selected ion monitoring, SIM)模式, 选择离子质量数分别为212/182 m/z和233/248 m/z。根据加入的内标含量进行定量分析。
4.精密度、准确性、样本回收率和残留分析 5 mL去离子水中分别加入SA(2 mg/mL甲醇)标准品1、2、5、10、20、40、80、120、240和480 μ L进行线性关系测定。取10份正常尿样测定SA浓度, 测定其正常参考值范围。同一样本连续测定7次, 连续7 d测定同一样本, 分析批内和批间变异系数(CV); 连续5 d处理同一样本, 分析其样本前处理批间CV。正常样本中加入一定量的SA和丙二酸标准品, 分析其回收率; 同时根据加入SA标准品与空白对照进行了残留分析。
5.质量控制 测定Cr时同时测定2个Cr质控样本, 定期校正Cr标准曲线。测定样本SA含量的同时, 测定加入一定量的SA标准品作为对照。
6.应用 用该方法测定高度怀疑有酪氨酸代谢障碍的13例患儿尿样本。
一、利用建立的方法检测到SA出现2个峰, 出峰时间约12.03和12.09 min, 丙二酸(内标)峰出现的时间约为8.68 min, 见图1。
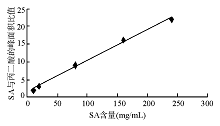
二、用本方法检测SA的线性范围为5~120 mg/mL, 线性方程为Y= 0.087 6X +1.435 8, r2= 0.997, 见图2。SA最低检测限为2 mg/mL, 最高检测限为480 mg/mL。本法批内CV为6.8%; 批间CV 7.8%; 回收率在94.0%~102.0%之间; 样本前处理CV为12.4%; SA残留分析< 1%。丙二酸(内标)回收率为95.0%~103.0%。10份正常样本中均未测到SA色谱峰。
三、用该方法检测了13例肝肿大、婴肝或血酪氨酸浓度升高的患儿, 确诊酪氨酸血症Ⅰ 型患者2例。患儿(1):女, 6岁, 肝脾肿大, 并伴有代谢性酸中毒, 父母为近亲结婚, 临床诊断为佝偻病或糖原累积症; 患儿(2):男, 3岁, 仅表现为肝脾肿大。2例患儿血酪氨酸均有升高, 分别为836和156 μ mol/L, 筛查尿有机酸, 两患儿尿样中均出现大量的4-羟基苯乙酸、4-羟基苯乳酸和4-羟基苯丙酮酸, 见图3。用本法测到患儿尿液中出现大量的SA, 其浓度为26和54 mmol/mol Cr, 因此诊断为酪氨酸血症Ⅰ 型。见图4。
1966年Tanaka等利用GC-MS诊断首例异戊酸血症后, 上世纪70年代起GC-MS广泛应用于遗传代谢病的筛查与诊断中, 成为目前有机酸代谢紊乱的主要检测方法[9, 10]。但由于常温下SA非常不稳定, 在患者中的浓度有时也不很高, 正常人尿液中SA更是非常低, 一般都低于质谱仪的检测极限。所以一旦尿液中检测到一定量的SA, 即可诊断为酪氨酸血症I型。目前广泛采用的有机酸筛查方法一般很难检测该化合物。本研究采用GC-MS中敏感性较高的SIM模式, 该模式允许只检测被选定的SA和丙二酸(内标)分子, 不检测其他可能提取的有机酸等化合物。所以SIM模式敏感性一般比检测所有有机酸的筛查模式高2~3个数量级, 一般用来检测体液中浓度较低的一个或特定的几个分子, 专门用于分析特定的某种疾病或疾病的鉴别诊断[6, 11]。近些年来国外先后报道了利用色谱质谱分析方法测定SA, 那些方法敏感性也很好, 但对实验室的条件有一定的要求, 作为医院的临床检测成本相对较高[6, 7]。本研究在以往方法的基础上, 采用更为简单节约的样本前处理方法, 在检测时对被检测样本设立一个对照测试样本, 同时加入内标, 保证每次分析时的准确性, 降低检测的假阳性率和假阴性率。
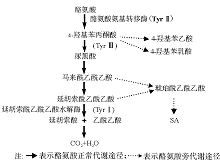
本研究利用本法确诊了2例高危的酪氨酸血症Ⅰ 型患儿。在采用GC-MS筛查尿有机酸时, 尽管2例患儿均查出尿样本中出现大量的4-羟基苯乙酸、4-羟基苯乳酸和4-羟基苯丙酮酸, 而仅根据此结果是无法区分患儿是酪氨酸血症Ⅰ 型还是Ⅲ 型。酪氨酸代谢途径见图5, 可看出这2种类型均可导致尿样中这2种异常代谢产物的升高, 而只有酪氨酸血症Ⅰ 型可导致患儿尿中出现大量的SA。本研究重新收集患者尿液并立即冰冻保存, 用本法成功的测到了2例患儿尿中均出现异常的SA色谱峰, 而尿液中大量的SA是确诊酪氨酸血症Ⅰ 型的标志物。一般情况下, 正常人尿液中SA浓度极低, 一般都低于检测极限, 文献[1]报道的参考范围为0~2.5 mmol/mol Cr。
结果表明, 经本研究改进的方法简单, 结果准确, 重复性好, 可为临床上鉴别诊断酪氨酸血症Ⅰ 型提供新的检测方法。不规范的样本收集和样本处理会导致假阴性结果, 所以样本必须冷冻或在冰块上运输送检, 同时需注意患儿如早期就具有肝脏疾病, 将有可能无SA的产生[12]。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|