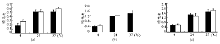作者简介:朱园园,女,1982年生,学士,技师,主要从事生物化学实验研究。
通讯作者:沈佐君,联系电话:0551-2283840-801。
评估一种国内自主建立利用唾液酸酶检测细菌性阴道病(BV)方法的临床应用价值。
方法比色法探索研发试剂与酶标准品的最佳反应条件,包括底物溶液的pH值和反应的最适温度及时间。采用研发试剂、BV BLUE、临床现用国产试剂盒对临床标本进行检测,判断研发试剂的临床应用价值。
结果研发试剂在pH值6.0~6.2、37 ℃ 10 min时与酶标准品达到最佳反应,与BV BLUE相比,检出限相同时研发试剂底物用量仅为BV BLUE的1/2.78。临床实验中,研发试剂与BV BLUE对BV的检测效果差异无统计学意义( P=1.000, Kappa=0.905),符合率为96%。而国产试剂盒与BV BLUE对BV的检测效果差异有统计学意义( P=0.000, Kappa =0 .362),符合率为65%。
结论研发试剂可以达到与BV BLUE相同的检出效果,其快速、方便、可信度高且成本较低,优于国内类似产品,更有利于在临床推广和使用。
To evaluate the diagnostic value of a new domestic method with sialidase for detection of bacterial vaginosis (BV).
MethodsThe optimal reaction conditions of the new reagent catalyzed by standard sialidase were explored according to colorimetric results, including pH, reacting temperature and time. Then we used clinical examples to verify the reliability of the new method as compared with the present domestic kit and imported BV BLUE kit.
ResultsThe new method reacted optimally at 37 ℃, 10 min in solution of pH 6.0-6.2. At the same detection limit, the dosage of substrate in new reagent was 1/2.78 of BV BLUE kit. In clinical evaluation, there was no significant difference of detection effect between new reagent and BV BLUE kit and the coincidence rate was up to 96%( P=1.000, Kappa=0.905). Whereas significant difference was found between another domestic kit and BV BLUE kit with the coincidence rate of 65%( P=0.000, Kappa=0.362).
ConclusionsThe new method has the same characteristics as BV BLUE kit, such as quickness, convenience, reliability, but decreased cost. It is better than an other similar domestic kit and suitable for clinical use in China.
细菌性阴道病(BV)是阴道内乳酸杆菌大量减少而厌氧菌群如普雷沃菌属、动弯杆菌、阴道加德纳菌及支原体等大量繁殖, 同时伴有阴道分泌物性质改变的一组综合征。BV与早产、自发流产、子宫内膜炎、输卵管炎、继发性不孕等多种妇产科疾病密切相关[1, 2], 可使患者对获得性免疫缺陷综合征(AIDS)和性传播疾病的易感性增加[3, 4]。唾液酸酶是BV患者阴道分泌物中致病菌分泌的特异性酶之一, 其活性被认为与BV感染水平呈正相关[5]。据此, 本研究以经美国食品与药品监督管理局(FDA)认证的Gryphus诊断试剂公司产品— — BV BLUE试剂盒为参照, 研发了一种能达到与BV BLUE试剂盒有相同检测效果的低成本的新型试剂, 以期为国内市场提供一个更好的选择。
安徽省立医院妇科门诊2007年10月至12月以外阴瘙痒、白带增多、有异味等症状就诊的患者138例, 平均年龄30岁。无菌长棉拭子采集患者阴道壁下1/3处分泌物3份(尽量多取且均匀一致), 取样前72 h内无性生活, 未使用阴道乳剂或灌注疗法, 避开经期。
唾液酸酶标准品(美国New England Biolabs公司)无菌分装, BV BLUE试剂盒(含底物IBX-4041, 美国Gryphus诊断试剂公司), 目的底物2-O-五甲蓝-a-D-N-乙酰唾液酸(MSTT)(美国LHE Bioscience公司何海音博士提供), 国产唾液酸酶一步法检测试剂盒(北京A公司), 显色剂NaOH。DU-530型分光光度计(美国Beckman公司), pHS-25B型数字酸度计(上海大普仪器有限公司), BX-41型倒置显微镜(日本Olympus公司)。
1. 底物IBX-4041、MSTT与唾液酸酶标准品最适反应pH值的检测 根据BV BLUE试剂盒说明书, 配制不同pH值的底物IBX-4041、MSTT缓冲液(前者为后者的2倍, 同一底物之间浓度相同), 分别加入足够量的酶标准品, 37 ℃水浴10 min, 加入显色剂混匀, 立即在波长590 nm(产物吸收峰)处比色, 以相同处理的无酶液调0, 根据产物量找出最适反应pH值。化合物IBX-4041为唾液酸酶专性生色底物, 经酶催化生成IBX-4050和唾液酸, 加入NaOH后显示蓝色, 即为阳性; 酶量不足时显示黄色, 即为阴性。底物MSTT为其类似物, 显色原理相同。
2. 最适pH值时对于目的底物MSTT的唾液酸酶最低检出限(LDL) 在最适pH值的MSTT缓冲液中加入不同单位标准酶, 反应条件同上, 记录峰吸光度值。同时以BV BLUE试剂盒作对照, 各重复3次取均值, 确定MSTT的LDL。
3. 确定使2种底物在相同反应条件下LDL相同的MSTT用量 BV BLUE试剂盒每管分别加入检出限量及其上、下量的标准酶, 以其结果为参照, 调节MSTT用量使二者具有相同阴阳性标准。
4. 临床应用中反应温度及反应时间的确定 应用BV BLUE和调整后的MSTT试剂盒, 酶量2、6和10 U, 分别在4、24和37 ℃反应10 min, 根据吸光度值找出最佳反应温度, 并在此温度下再次分别反应3、5和10 min, 比较后判定最佳反应时间。
5. 临床标本验证 根据优化后条件制成MSTT试剂盒, 与BV BLUE、临床所用国产试剂盒同时对每一位患者3个拭子进行检测, 并以BV BLUE试剂盒为标准, 均严格按照说明书操作。对于MSTT与BV BLUE检测结果不一致者立即重取标本按Amsel法[6]复查:(1)阴道pH值> 4.5; (2)阴道分泌物增多, 变稀薄如奶状, 有异味; (3)胺试验(Whiff)阳性, 即在阴道分泌物中加入10 %KOH产生鱼腥味; (4)阴道分泌物涂片中可见线索细胞。上述4项中有3项以上符合即可判断为BV阳性。
应用SPSS 13.0软件, 临床标本结果比较运用配对设计McNemar χ 2检验法和Kappa检验法。Kappa≥ 0.7表示2种方法吻合度较强, 0.7> Kappa≥ 0.4表示吻合度一般, Kappa< 0.4表示吻合度较弱。反应温度和时间中的比较采用单因素方差分析, 组间两两比较采用LSD法, P< 0.05为差异有统计学意义。
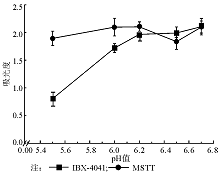
由于底物浓度及酶量均相同且底物过量, 因此酶的催化活性与产物的量呈正向变化, 可以用产物吸光度较高者对应的pH值作为酶的最适pH值, 结果见图1。2种产物吸光度由pH值5.5至6.0时上升明显, 而pH值继续增加则吸光度变化不大, MSTT在pH值6.5时甚至有所下降, 认为底物缓冲液与标准唾液酸酶反应的最佳pH值为6.0~6.2。考虑到临床BV患者实际阴道pH值多在5.0~6.5之间[7](正常人pH值3.5~4.5[8] ), 为避免偏酸性标本对反应液的影响, 临床使用时底物缓冲液宜在pH值6.0~6.5。综合选择图1中MSTT“ 拐点” 处即pH值6.0作为后续实验溶液pH值。此时产物均肉眼可见深绿或蓝色, 即为阳性。
据预实验结果逐步减少酶的用量并缩小差距, 确定酶的浓度梯度; 根据肉眼能分辨颜色变化的程度及在波长扫描中是否有产物峰和对应的峰吸光度高低判断LDL。反应后溶液颜色随产物量增加由黄至蓝逐渐变化, 见表1、2。根据表中结果认为, 在BV BLUE底物用量为目的底物的2倍时, 目的底物MSTT在pH值6.0条件下所需标准酶的LDL为0.75 U, BV BLUE底物所需酶的LDL为1.25 U。根据以上结果, 以BV BLUE底物所需酶的LDL为标准, 调节目的底物用量使二者一致, 即阴阳性标准相同, 发现此时目的底物的用量仅为BV BLUE底物的1/2.78, 即0.09 mg。
| 表1 不同含量标准酶与MSTT作用的吸光度、产物颜色及判定 |
| 表2 不同含量标准酶与IBX-4041作用的吸光度、产物颜色及判定 |
根据现有资料对唾液酸酶一般反应特性描述, 应用调整后的底物量在寒冷及室温状态下与不同含量酶反应, 结果以波长590 nm处吸光度表示, 见图2。通过对a、b、c图行单因素方差分析认为, 对于MSTT, 每张图中4、24和37 ℃之间吸光度变化均有统计学意义, 其中Fa=45.94(Pa=0.000); Fb=52.079(Pb=0.000); Fc=86.733(Pc=0.000)。并且经LSD法两两比较发现, 每张图中37 ℃与24 ℃时的吸光度升高差异具有统计学意义, P值分别为0.013、0.015、0.012, 均< 0.05。因此, 对于MSTT, 酶在37 ℃时催化活性最好, 较冷条件下(4 ℃)易造成假阴性而不宜应用, 4 ℃保存的试剂应先恢复到室温再于37 ℃检测。另一种底物也有类似结论。
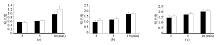
采用最佳温度37 ℃分别反应3、5和10 min, 见图3。结果显示, 2种底物均能快速反应, 对于MSTT, a、b、c图中3 min与5 min产物颜色和吸光度差异均不明显, 并且经LSD法两两比较发现差异无统计学意义(Pa=0.205, Pb=0.202, Pc=0.146, 均> 0.05), 而10 min时则反应很充分, 与5 min相比吸光度有了大大提高(Pa'=0.000, Pb'=0.002, Pc'=0.006, 均< 0.05), 外观上在酶量低至2 U时也呈浅蓝色, 阳性明显。因此在综合考虑速度与效率的前提下, 选用10 min为最佳反应时间。
临床试验中138例疑似患者BV BLUE阳性检出率为26%, 研发试剂为25%。研发试剂敏感性为92%, 特异性为98%, 符合率为96%, 阳性预测值为94%, 阴性预测值为97%。经Mc-Nemar χ 2检验和Kappa检验分析, 研发试剂与BV BLUE相比差异无统计学意义, 2种试剂吻合度较强, 见表3。其中有5例结果不一致, 经Amsel标准判断认为:研发试剂阳性、BV BLUE阴性2例标本, Amsel结果阳性 1例, 阴性1例; 研发试剂阴性、BV BLUE阳性3例标本, Amsel阳性2例, 阴性1例。
| 表3 研发试剂盒对138例门诊患者BV检测结果 |
应用市场销售的某国产试剂其阳性检出率为59%, 敏感性为97%, 特异性为54%, 符合率为65%, 阳性预测值为43%, 阴性预测值为98%。经McNemar χ 2检验和Kappa检验分析, 国产试剂与BV BLUE相比差异有统计学意义, 2种试剂吻合度比较弱, 见表4。
| 表4 国产试剂盒对138例门诊患者BV检测结果 |
健康女性阴道中厌氧菌与需氧菌数量比为2:1~5:1[9], 正常情况下阴道通过自净作用维持内环境的稳定, 抵御外来微生物感染。当卵巢功能紊乱导致雌激素水平下降或人为因素使pH值升高等破坏菌群平衡时[7], 原本占优势的乳酸杆菌被阴道加德纳菌及其他厌氧菌群等机会致病菌所取代, 造成病理上无明显炎症的BV(因厌氧菌群如类杆菌属及普雷沃菌属分泌的唾液酸酶可间接促进白细胞的分解)[10]。正由于其感染症状不明显且常易复发, 致病菌产生的黏蛋白水解酶一再使阴道黏膜屏障受损, 导致其他病原体更易入侵, 产生局部感染和全身症状[11]。因此BV对女性特别是孕妇的身心健康构成了很大的潜在威胁。
BV的实验室诊断金标准为Amsel法, 其成本低廉, 但指标易受到主客观因素多种干扰, 尽管后人发展出了多胺检测卡、革兰染色评分检测线索细胞等改良方法, 仍存在耗时长、操作繁琐等缺点, 不利于临床快速诊断需要。近年来BV诊断依靠对致病菌特异性代谢酶类的生化检测, 如脯氨酸氨肽酶[12]、黏蛋白水解酶[13]、唾液酸酶[14]、乳酸脱氢酶[15]等, 尤以唾液酸酶法商品试剂盒发展最为迅速、广泛, 如美国Gryphus诊断试剂公司90年代开发的BV BLUE试剂盒上市后, 已获FDA认证及专利保护, 以其简便、快速、准确的优点在欧美许多国家大量应用。但由于单靠进口价格昂贵, 其在国内的使用受到很大限制。目前各大医院多采用国产唾液酸酶法检测试剂盒, 根据其中是否加入显色剂又可细分为一步法与两步法。国产试剂普遍价格低廉, 但市场上产品质量良莠不齐, 临床应用时很难保证结果的可靠性, 易造成漏诊、误诊。因此, 我们与美国哥伦比亚大学合作, 以BV BLUE为参考, 研发出了底物关键成分— — MSTT, 并确定了新试剂盒的最佳反应条件, 如底物的量、缓冲液的pH值、反应温度和时间。经过临床初步测试认为其敏感性高(92%), 特异性好(98%), 与BV BLUE检验结果具有很高的符合率(96%)。仅有5例结果不符, 可能原因有3方面:(1)标本差异:如分泌物性质不均匀或取材部位、多少略有不同, 存在酶活性差异, 这种影响需临床医师严格按要求取样来避免; (2)操作误差:如显色剂滴加过少、仅棉拭子局部变色、反应液未混匀就判读等, 另外加入显色剂后需在2~3 min内判断; (3)试剂盒本身差异:虽然原理相同, 但2种底物的量、对酶的选择性、其他试剂均有不同, 临床标本又是混合物, 可能会有一定程度差异, 有待于后期进一步调整。主要还是标本含酶量可能比较低, 临界处颜色判断易受主观因素影响所致。另外BV BLUE与Amsel结果有2例不一致, 我们认为这种差异是由于2者判断标准不同所致, 前者为酶类生化检测, 与细菌种类、产酶株数量和酶活性相关, 检测结果相对稳定; 而后者每项都易受干扰因素影响, 如气味的强弱判断因人而异, 线索细胞的认定可能受杂质或细菌黏附性增强影响等。当然BV BLUE结果也并非完全特异, BV的确诊最终还要依靠临床医生综合病史、症状及实验室诊断得出。
在新试剂盒研制成功的同时, 比较了国产一步法试剂盒, 发现其虽然敏感性高(97%), 但特异性相当低, 假阳性率高达46%, 与BV BLUE符合率仅有65%, 结果并不完全真实可靠。因此认为就检测效果而言, 新试剂不仅在二步法产品中接近国际先进标准, 且优于现有一步法产品。就成本而言, 新试剂盒约为10元人民币, BV BLUE和国产试剂盒为其2~3倍, 所以新试剂盒除了同样具备简便、快速、直观的优点外, 还大大节省了试剂成本, 利于在各级医院推广使用。根据以上研究认为, 本试剂在经过更多的临床验证后完全有望成为BV BLUE在国内的替代产品, 应用前景十分广阔。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|