作者简介:莫 薇,女,1974年生,硕士,讲师,主要从事微生物免疫研究。
通讯作者:高 锋, 联系电话: 021-64369181-8702。
探讨高相对分子质量透明质酸(nHA)和低相对分子质量透明质酸(oHA)对脐静脉内皮细胞增殖能力及膜-细胞骨架连接蛋白埃兹(Ezrin)表达的影响。
方法分别用nHA和oHA处理人脐静脉内皮细胞,以5-溴脱氧尿嘧啶核苷(Brdu)酶联免疫吸附试验(ELISA)检测透明质酸(HA)作用后细胞增殖能力;用荧光实时定量聚合酶链反应(PCR)和蛋白免疫印迹试验(Western blot)检测HA对Ezrin mRNA和蛋白表达的影响。
结果与对照组相比,72 h后oHA(10 μg/mL)显著促进血管内皮细胞增殖( P<0.001),24 h后促进Ezrin基因的表达,48 h后促进Ezrin蛋白磷酸化表达。而nHA(200 μg/mL)则抑制血管内皮细胞的增殖( P<0.01)和Ezrin蛋白的表达磷酸化。
结论oHA能有效促进血管内皮的增殖并促进其胞内连接蛋白Ezrin的表达磷酸化,nHA则抑制内皮细胞的增殖和Ezrin蛋白的表达。
To investigate the effects of native high molecular weight hyaluronic acid (nHA) and low molecular weight hyaluronic acid(oHA) on the proliferation of human umbilical vein endothelial cell and the expression of membrane-cytoskeleton linker protein Ezrin.
MethodsCell proliferation ability was detected by 5-bromo 2-deoxyuridine (Brdu) enzyme-linked immunosorbent assay (ELISA). Expression of Ezrin mRNA and protein was detected by real-time polymerase chain reaction(PCR) and Western blot after being treated with oHA and nHA in human umbilical vein endothelial cells.
ResultsHuman umbilical vein endothelial cell proliferation ability was higher than control group after being treated with oHA at the concentration of 10 μg/mL for 72 h( P<0.001). Ezrin mRNA expression was upregulated after being treated with oHA for 24 h. The expression of Ezrin protein ,especially the expression of phosphorylated Ezrin was upregulated by oHA for 48 h. nHA (200 μg/mL)inhibited human umbilical vein endothelial cell proliferation ( P<0.01) and Ezrin phosphorylated.
ConclusionsoHA may promote endothelial cell proliferation and the expression of membrane-cytoskeleton linker protein Ezrin. nHA inhibits cell proliferation and the expression of Ezrin.
糖分子是细胞外基质的重要组成成分, 与胶原、蛋白等结合构成复杂的网架结构, 支持并连接组织结构, 调节组织的发生和细胞的生理活动。透明质酸(HA)是惟一不发生硫酸化的氨基聚糖, 由重复的D-葡糖醛酸和N-乙酰-D-葡糖胺的双糖单位组成[1], 其糖基数可多达10万个。病理情况下, HA可被分解为寡糖结构。通常将未分解的高相对分子质量HA(nHA)称为透明质酸多糖, 分解后的低相对分子质量HA(oHA)称为透明质酸寡糖。nHA和oHA虽然具有相似的糖醛酸结构, 但对细胞生长和转移方面的影响却并不相同。据文献报道, oHA主要在5~20 μ g/mL时发挥其促进细胞增殖的作用[2, 3], 而nHA则在100 μ g/mL以上才发挥作用[4]。但调控不同相对分子质量HA分子具有不同功能的机制至今仍无定论。本研究分别用nHA和oHA诱导内皮细胞, 通过检测内皮细胞增殖状况及与体内HA受体CD44接合蛋白埃兹(Ezrin)的表达, 探讨2类HA对脐静脉内皮细胞增殖能力的影响及与胞内连接蛋白Ezrin表达的相关性, 希望发现影响HA促进内皮细胞增殖的机制。
人脐静脉内皮细胞取自上海市第六人民医院剖腹产婴儿新鲜脐带, 磷酸盐缓冲液(PBS)冲洗干净后, 用Ⅰ 型胶原酶(Invitrogen公司)灌注消化法分离细胞, EBM-2 (Lonza公司)培养基培养传代, 37 ℃ 5%CO2培养, 细胞呈铺路石样排列, 流式细胞仪检测CD31表达, 1, 1'-二十八烷醇-3, 3, 3', 3'-四甲基-羰青高绿酸盐标记的乙酰化低密度脂蛋白(DiL-AC-LDL)染色和免疫荧光检测Ⅶ 因子证实为内皮细胞。
nHA购自Sigma公司; oHA (4-20mer)为本实验室制备[2]。EBM-2和EGM-2培养基购自Lonza公司; 10 μ g/mL oHA和200 μ g/mL nHA 由EBM-2培养基配制; 5-溴脱氧尿嘧啶核苷(Brdu)增殖检测试剂盒购自Chemicon公司; 兔抗人Ezrin抗体和磷酸化Ezrin(Thr567)抗体购自Cell Signal公司; 逆转录聚合酶链反应 (PCR)试剂购自TaKaRa公司; 免疫印迹试验(Western blot) 使用Bio Rad 公司电泳及转移设备; 实时定量 PCR使用罗氏公司Roche Light Cycle3荧光定量PCR仪。
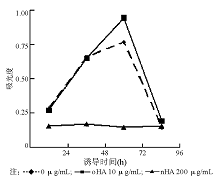
1. Brdu细胞增殖能力检测 将培养好的人脐静脉内皮细胞接种入96孔板中(1× 104/孔), 6复孔。培养24 h后加入EBM-2空白培养基平衡12 h, 加入终浓度分别为10 μ g/mL的oHA以及200 μ g/mL的nHA。对照组为EBM-2空白培养基。分别于加药后24、48、72和96 h用Brdu 酶联免疫吸附试验(ELISA)检测细胞增殖能力。方法:HA作用结束前2 h加入Brdu, 2 h后弃去培养基, 固定细胞, 加入抗Brdu一抗, 室温30 min后洗涤液洗3次, 加入辣根过氧化物酶(HRP)标记二抗, 室温孵育30 min, 洗3次, 显色后终止反应, 450 nm波长测定吸光度。根据吸光度绘制生长曲线, 比较加入oHA和nHA后细胞的增殖能力。
2. 实时定量PCR检测Ezrin基因的表达 4× 105/孔人脐静脉内皮细胞接种至6孔板中, 培养24 h细胞约50%~60%融合后, 加入EBM-2空白培养基平衡12 h, 加入终浓度10 μ g/mL的oHA和终浓度200 μ g/mL的nHA各2 mL, 对照为EBM-2空白培养基。于12、24、48和72 h几个时间段收集细胞。预冷的PBS冲洗2次后, 采用常规Trizol(Invitrogen公司)法提取细胞总RNA, 紫外分光光度计测纯度。用TaKaRa公司逆转录试剂盒逆转录为cDNA, TaKaRa公司荧光定量PCR试剂盒(SYBR GreenⅠ 法)做实时定量PCR扩增, 观察Ezrin基因的变化情况。实时定量PCR引物由英骏公司合成, 分别针对Ezrin基因和内参3-磷酸甘油醛脱氢酶(GAPDH)基因设计引物。Ezrin正义链:5'-AACCAATCAATGTCCGAGTTAC-3', 反义链:5'-GGCCAAAGTACCACACTTCC-3'; GAPDH: 正义链:5'-GCACCGTCAAGGCTGAGAAC-3', 反义链:5'-GAAGACGCCAGTGGACTCCA-3'。采用罗氏公司Roche Light Cycle3荧光定量PCR仪做实时定量PCR分析。反应条件为:第1步, 95 ℃ 10 s, 10个循环; 第2步, 95 ℃ 5 s, 60 ℃ 20 s, 45个循环; 第3步, 95 ℃ 0 s, 65 ℃ 15 s, 95 ℃ 0 s。采用相对定量分析 2-△ △ Ct 法 进行统计分析。Ct值为PCR扩增过程中每个反应管内的荧光信号达到设定的域值时所经历的循环数。△ △ Ct=(加药组Ezrin Ct 值-加药组GAPDH Ct值)-(对照组Ezrin Ct 值-对照组GAPDH Ct 值) , 2-△ △ Ct表示加药各组目的基因mRNA 表达的拷贝数与对照组目的基因拷贝数相比的倍数。
3. Western blot 分析Ezrin蛋白的表达 取对数生长期人脐静脉内皮细胞, 约4× 105 /孔接种于6孔板中, 培养24 h待细胞长至约50%~60%融合后, 加入EBM-2空白培养基平衡12 h, 加入10 μ g/mL oHA及 200 μ g/mL nHA各2 mL, 对照组为EBM-2空白培养基。培养24、48和72 h后弃去培养基, 预冷的PBS冲洗2次后每孔加入细胞裂解液100 μ L, 刮取细胞至1.5 mL离心管中, 二喹啉甲酸 (BCA)法蛋白定量后, 以5:1比例加入5× 蛋白电泳上样缓冲液, 100 ℃ 5 min蛋白变性后进行十二烷基硫酸钠(SDS)凝胶蛋白电泳, 电泳结束后转至聚偏氟乙烯(PVDF)膜, 5%脱脂奶粉封闭1 h后加入磷酸化Thr567位Ezrin抗体4 ℃过夜, 0.1%吐温-20的三羟甲基氨基甲烷(Tris)-HCl 缓冲液(TBST)洗3次, 每次5 min, 加入HRP标记的羊抗兔IgG, 室温孵育1 h, 加TBST洗3次, 每次5 min, 增强化学发光(ECL)显色液显影, X光胶片曝光。以GAPDH(抗GAPDH抗体购自上海康成生物公司)为内参照。将转有目的蛋白的PVDF膜用一抗二抗去除液除去第1次结合的磷酸化Ezrin抗体后, 重新用5%脱脂奶粉封闭1 h, 加入Ezrin抗体, 按上述方法重新曝光显影。
所有数据以
nHA和oHA对人脐静脉内皮细胞的增殖具有不同的影响, 与对照组相比, oHA从作用24 h后开始促进细胞增殖, 72 h具有最佳增殖效果。 nHA与对照组相比, 则抑制细胞增殖。见表1、图1。
| 表1 oHA和nHA对人脐静脉内皮细胞增殖率的影响(72 h) |
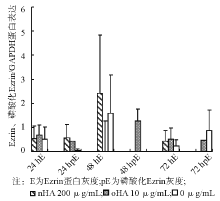
实时定量PCR扩增发现, 加入oHA 组反应24 h后Ezrin基因表达升高, 升高率约为对照组的1.55倍(P< 0.05)。其余不同加药组和时间组Ezrin基因表达均无明显升高, 差异无统计学意义。
作用24 h后, 各处理组细胞Ezrin蛋白Thr567位点无显著磷酸化表达, Ezrin蛋白表达差异亦无统计学意义。48 h后, oHA处理组Ezrin蛋白Thr567位点出现显著磷酸化, nHA组和对照组无显著磷酸化, oHA组的Ezrin蛋白表达也出现显著增高。72 h后3个处理组Ezrin蛋白均出现部分磷酸化, 但表达较低, 差异无统计学意义。Ezrin表达差异亦无统计学意义。 见图2、3。
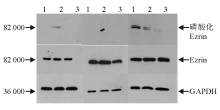 | 图2 oHA 与nHA 诱导人脐静脉内皮细胞后Ezrin蛋白和磷酸化Ezrin(Thr567) 蛋白的表达(24 、48 和72 h)注:1为对照; 2为oHA 10 μ g/mL; 3为nHA 200 μ g/mL |
HA是包裹细胞胞外基质的重要糖分子, 由重复的D-葡萄糖醛酸和N-乙酰-D-葡糖胺的双糖单位组成[1]。天然nHA围绕在动物细胞周围, 发挥结构支撑与抗炎、抑制免疫反应[5]和抗新生血管形成的作用[6]。病理条件下nHA降解为oHA, oHA具有促进炎症发生、刺激机体免疫[7]和促进血管新生的作用[8]。研究发现, 同由多个糖醛酸结构组成的oHA和nHA虽然只有糖醛酸数量上的差异, 但对血管内皮的促增殖效应却完全不同[2, 3], oHA一般被认为促进血管内皮增殖[8], 而nHA则抑制血管内皮增殖[6]。这种相对分子质量不同, 但结构及组成完全相同的物质造成不同增殖效果的现象虽然早被研究者发现, 但其机制如何仍不清楚。我们的研究希望在证实oHA和nHA分别促进和抑制血管内皮增殖的基础上, 找到影响此功能的相关因素。
CD44又称HA受体, 其分子为跨膜结构, 胞外端与HA分子相连, 而羧基端则伸入胞内与Ezrin蛋白家族(ERM)等胞内分子相连。在HA促细胞增殖机制的研究中CD44是重要的研究对象[9, 10]。 ERM是在胞内连接CD44受体和肌动蛋白骨架蛋白的重要分子[11, 12], 是近期研究细胞增殖、转移的热点分子。Ezrin是ERM蛋白家族的原型。很多研究发现, Ezrin的高表达与肿瘤细胞的增殖和转移高度相关[13]。由于Ezrin蛋白分子与CD44分子一起共表达于细胞膜表面, 而HA分子直接作用于CD44受体, 我们怀疑HA的促血管内皮增殖效应可能与Ezrin分子表达相关。因此我们在研究中以人脐静脉内皮细胞为靶点, 用nHA和oHA分别处理脐静脉内皮细胞, 检测HA作用后细胞的增殖和Ezrin分子的表达状况。通过细胞增殖实验发现, oHA作用人脐静脉内皮细胞一定时间后细胞出现明显增殖, 与增殖效应高度相关的Ezrin蛋白Thr567位点磷酸化表达显著增高, Ezrin蛋白表达水平也有一定程度的增高[2]。而用nHA作用后细胞增殖能力与对照组相比显著降低, Ezrin蛋白表达水平未见明显改变, Thr567位点的磷酸化表达显著低于对照组和oHA处理组或无磷酸化表达。通过实时定量PCR分析不同处理组Ezrin分子的 mRNA表达, 发现oHA作用24 h后Ezrin mRNA表达有一定程度增加, 但其他不同处理组(oHA, 12、48和72 h; nHA, 12、24、48和72 h)mRNA改变均无统计学意义。提示Ezrin蛋白的基因水平在HA的处理下并没有显著改变。
本研究通过Brdu增殖实验证实oHA可促进内皮细胞增殖, nHA则抑制内皮细胞增殖。实时定量PCR和Western blot提示oHA促进内皮细胞增殖的机制可能是oHA促进了Ezrin蛋白的Thr567位点的磷酸化, 而与Ezrin基因的过表达的相关性并不显著。在以往的研究中发现一些生长因子, 如表皮生长因子(EGF)、肝细胞生长因子(HGF)等均可引起Ezrin磷酸化和表达增高[14], 证实Ezrin蛋白的Thr567位点的磷酸化正是促进细胞增殖的重要因素。提示oHA可能是通过促进Ezrin Thr567位点的磷酸化而促进细胞增殖的, 并与细胞信号转导的丝裂原活化蛋白激酶(MAPK)途径相关。我们的研究结果显示, nHA在降解为oHA后具有促进内皮增殖的能力, 且其增殖机制可能类似某些细胞因子, 主要通过促进相关蛋白的磷酸化表达达到促进内皮增殖的作用。但这种激活蛋白磷酸化的机制及相关信号转导分子和途径是否与其他生长因子的作用途径相似尚有待进一步研究。同时Ezrin在胞内分布部位不同会影响细胞的生长和转移, HA作用是否影响Ezrin蛋白在胞内的分布, 其促增殖作用是否与Ezrin蛋白在胞内的分布部位有关也需要进一步研究和探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|