作者简介:黄东标,男,1968年生,主管技师,主要从事临床检验工作。
探讨用实时荧光定量PCR(FQ-PCR)检测孕妇血浆中胎儿RhCcEe基因的可行性。
方法用QIAamp DNA Kit抽提孕妇血浆DNA,应用9个(D3S1358、VWA、FGA、D5S818、D13S317、D7S820、D8S1179、D21S11、D18S51)具有高度多态性的短串联重复序列(STR)位点,对孕妇血浆样本中DNA进行STR等位基因扩增。同时检测孕妇丈夫外周血来源DNA,通过胎儿父源性等位基因在孕妇血浆中的检出确认胎儿DNA的存在。通过FQ-PCR法检测34例孕妇血浆中胎儿RhCcEe基因,并对出生后婴儿脐带血进行RhCcEe血清学表型分析,回顾性评价胎儿基因分型结果的准确性。
结果在10例母亲表型为ee纯合子的样本、11例母亲表型为CC纯合子的样本、5例母亲表型为EE纯合子的样本及8例母亲表型为cc纯合子的样本中均分别检测到了母亲所缺少的E、c、e、C基因,这与出生后婴儿外周血血清学分型相吻合。
结论FQ-PCR法是一种灵敏度和准确性高,且特异性强的非创伤性产前诊断胎儿RhCcEe基因型的方法,当母亲为纯合子时,血将中胎儿RhCcEe基因分型具有临床意义,可用于新生儿溶血病的预防和诊断。
Rh血型系统在临床输血医学中的重要性仅次于ABO血型系统[1], Rh血型不合会引起溶血性输血反应及新生儿溶血病(hemolytic disease of the newborn, HDN)[2]。产前诊断RhD基因的研究在国外已经广泛开展[3~6], 但有关胎儿RhCcEe基因型产前诊断相关报道较少[7, 8]。我们应用荧光定量聚合酶链反应(FQ-PCR)法检测孕妇血浆中游离胎儿DNA的RhCcEe基因型。
筛选2003年1月至2006年4月来磐安县人民医院进行产前抗体检测的孕妇。孕妇为首次妊娠, 孕周为16~40周, 筛选Rh表型为纯合子的孕妇。抽取孕妇全血5 mL[乙二胺四乙酸(EDTA)抗凝], 相对应每位孕妇均取其丈夫全血2 mL(EDTA抗凝)作对照。自然分娩后抽取其婴儿脐带全血2 mL(EDTA抗凝), 进行Rh表型鉴定及随后对照实验。从上述样本中再次筛选母亲表型是纯合子的样本RhCC 11例、cc 8例、EE 5例或ee 10例。
1.主要仪器与试剂 Chromo4TM荧光定量PCR扩增仪(美国BIO-RAD公司); PTC-240型DNA扩增仪(美国BIO-RAD公司); DNA-plus真空干燥仪(丹麦); DNA测序仪(美国ABI377); Genescan软件(美国ABI公司); AmpF1 STR Cofiler试剂盒(美国ABI公司); Chelex-100(Sigma公司); Genegenius凝胶成像系统(英国Syngene公司); PCR缓冲液(10× buffer)、10× dNTP、MgC12、Tap DNA聚合酶(日本Takara公司); 血浆DNA提取试剂盒QIAamp DNA Midikit(德国Qiagen公司); 抗C、抗c、抗E、抗e血清学试剂(加拿大Dominion生物技术有限公司); SRY、RhC/c、RhE/e引物和荧光探针由上海基康生物技术有限公司合成。
2.血浆的制备和DNA提取 孕妇外周血标本3 000 r/min(离心半径为15 cm)离心10 min, 血浆移入新无菌管, 去除脂质等杂质, 再次3 000 r/min(离心半径为15 cm)离心10 min, 血浆移入新无菌管, -80 ℃保存备用。孕妇血浆中胎儿DNA提取严格按血浆DNA提取试剂盒说明书进行, DNA浓缩采用DNA-plus真空干燥仪。孕妇与其丈夫和婴儿DNA提取严格按Chelex-100试剂盒说明书提取。
3.引物和探针的合成 引物和探针参照文献[9]设计合成, 见表1。
4.RhCcEe表型血清学检测 RhC/c、RhE/e表型血清学测定严格按试剂说明进行操作。
5.孕妇与其丈夫全血DNA STR等位基因扩增 参照本实验室常规检测方法, 同时扩增9个STR位点, 分别为D3S1358、vWA、FGA、D8S1179、D21S11、D18S51、D5S818、D13S317和D7S820。反应体积为10 μ L, 其中PCR混合液4 μ L, Tap Gold DNA聚合酶2.0 U, 引物混合液0.2 mmol/L, 样本DNA 0.4 mmol/L, 混匀后在PTC-240型DNA扩增仪上扩增; 95℃变性11 min, 随后94 ℃ 1 min, 59 ℃ 1 min, 72 ℃ 1 min, 28个循环; 60 ℃保温45 min。
6.孕妇血浆DNA STR等位基因扩增 反应体系同上, 扩增参数改为40个循环。
| 表1 SRY、RhC/c、RhE/e分型引物序列 |
7.PCR扩增产物电泳和等位基因确定 将1.5 μ L甲酰胺兰与0.3 μ L ROX500内标先混合, 然后取1.5 μ L于样本管中, 再加入1.5 μ L PCR扩增产物, 95 ℃变性3 min后立即放入冰浴中, 在5%聚丙烯酰胺凝胶上电泳分离, 电压15 kV, 温度51 ℃。用Genescan分析软件分析其基因型。
8.RhC/c基因、RhE/e基因FQ-PCR 反应总体积为25 μ L, 其中含样本DNA 2.5 μ L, PCR10× buffer 2.5 μ L, Tap 2.0 U, dNTP、MgC12终浓度分别为0.2 mmol/L和4.0 mmol/L。RhC/c-F和RhC/c-R引物终浓度均为0.4 mmol/L, RhC/c-P荧光探针终浓度为0.2 mmol/L; RhE/e-F和RhE/e-R引物的终浓度为0.8 mmol/L, RhE/e-P荧光探针终浓度为0.2 mmol/L。扩增条件为94 ℃预变性10 min, 94 ℃10 s, 60 ℃45 s, 45个循环。每个循环结束时自动检测1次荧光值。
9.SRY基因FQ-PCR 反应总体积为25 μ L, 其中含样本DNA2.5 μ L, PCR10× buffer 2.5 μ L, Tap2.0 U, dNTP、MgC12终浓度分别为0.2 mmol/L和4.0 mmol/L, SRY-f和SRY-r引物终浓度为0.3 mmol/L。SRY-p荧光针浓度为0.2 mmol/L。扩增条件为95 ℃预变性5 min, 95 ℃15 s, 60 ℃45 s, 45个循环。每个循环结束时自动检测1次荧光值。
10.PCR产物检测 分别取上述RhC/c基因、RhE/e基因、SRY基因荧光定量PCR扩增产物8 μ L, 在含0.5 mg/L溴化乙锭的20 g/L琼脂糖凝胶中电泳, 用凝胶成像仪观察结果并作出判断。
11.质量控制 每个样本做3次平行扩增, 其中大于2次扩增为阳性的才判断为阳性, 每次实验设置试剂空白对照管, 阴性对照和阳性对照管。
将标准品梯度稀释做灵敏度试验, 有阳性扩增曲线出现的最低量即为此方法可以检测到的最高灵敏度。标准品初浓度起始模板量为10 μ g, 当SRY、RhC、Rhc、RhE、Rhe基因的起始模板量分别在0.1、1.0、1.0、1.0、0.1 ng时扩增曲线仍为阳性。19例孕妇血浆样本均扩增出SRY基因, 均分别检测到了母亲所缺少的CcEe基因, 灵敏度为100%。
19例孕妇血浆样本均扩增出SRY基因, 均分别检测到了母亲所缺少的CcEe基因, 这一结果与出生后胎儿性别相符合, 与出生后婴儿脐带血RhCcEe血清学分型相吻合, 特异性为100%。
结果见表2。
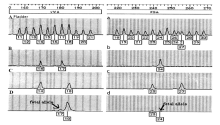
比较孕妇血浆、孕妇及基丈夫全血DNA的STR结果, 19例孕妇血浆样本中全部检出胎儿父源性等位基因, 即胎儿DNA。以VWA位点和FGA位点的电泳图谱为例, 见图1。
19例样本均扩增出母亲纯合子所不具备的父源性胎儿等位基因。每个样本均做3次平行扩增, 其中≥ 2次扩增为阳性的才判断为阳性, 结果见表2。
| 表2 母亲、婴儿RhCcEe表型、母亲血浆胎儿RhC/c、E/e, SRY基因分析 |
HDN在临床上发病率约为1%。Rh血型不合所致HDN虽少见, 但是一旦发生则病情严重。Rh血型系统中最重要的抗原有D、C/c、E/e。研究表明针对D、c、E、C、e等抗原的抗体均能引起HDN, 因此通过产前诊断胎儿Rh血型来预测和治疗HDN具有重要的意义。
由于孕妇血浆中同时存在着胎儿DNA及大量母体DNA, 为了证明母亲血浆中胎儿DNA是否抽提成功, 检测STR位点的多态性是一种区分母胎DNA的可行方法。STR是理想的DNA遗传标记, 是以核心序列重复单位数目的变化遗传多态性, 广泛存在于人类基因组中的一类具有高度多态性的遗传学标记。我们同时扩增9个具有高度多态性的短串联重复序列STR位点, 分别为D3S1358、vWA、FGA、D8S1179、D21S11、D18S5、D5S818、D13S317和D7S820, 对孕妇血浆样本中DNA、胎儿父亲DNA、孕妇全血DNA进行上述9个位点STR等位基因扩增, 并且经过比对父方STR结果后, 确认19份样本中均有胎儿DNA的存在。
FQ-PCR有以下优点:比普通PCR技术灵敏度高; 对PCR循环进行实时监测, 避免了扩增产物而致的假阳性; 探针杂交特异性更强; PCR后无需后续处理; 安全无污染。本研究用FQ-PCR法检测孕妇血浆中游离胎儿DNA的RhCcEe基因型, 灵敏度、特异性为100%。而据Smid[10]报道, 采用定性PCR方法检测孕妇血浆中的胎儿DNA, 灵敏度和特异性较低。本研究为避免假阳性, 严格进行无菌操作, 使用带过滤的吸头, 从采血到PCR实验操作整个过程均由女性完成, 每次设置空白对照、阴性对照和阳性对照, 每个样本重复3次, 实验结果显示, 所有样本均无假阳性发生, 保证了结果的可靠性。
本研究中的19例样本RhCcEe基因型检测特异度及灵敏度均达100%, 无1例假阳性产生。且实验的重复性好。由于只有母亲缺乏胎儿特有的父源性抗原才会引起HDN, 因此可以利用本技术特异检测父源性抗原, 当孕妇为RhCC、cc、EE、ee纯合子时, 本方法能准确检测出孕妇所缺少的c、C、e、E基因, 提示这些纯合子孕妇在产生抗体的可能性。故对纯合子孕妇进行产前诊断胎儿RhCcEe基因型具有非常重要的临床意义, 可预测RhCcEe引起的HDN, 及早进行治疗。Li等通过胎儿DNA片段大小的选择性富集, 以排除血浆大量母体DNA的干扰, 从而使父系和母系遗传的DNA多态性检测更为可行和容易。我们今后应当致力于如何能够使孕妇血浆中胎儿DNA获得进一步纯化, 得其高浓度和纯度, 从而使产前诊断进一步更广泛、深层、且简便的开展。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|