作者简介:张 哲,男,1971年生,硕士,副主任技师,主要从事微生物和免疫学检验研究。
建立流式细胞术(FCM)快速检测念珠菌药物敏感性的方法。
方法选定了3种代表性染料:碘化丙啶(PI)、FUN-1和DiOC5(3),采用FCM测定60株临床分离的念珠菌对氟康唑(FLC)和两性霉素B(AMB)的敏感性,并与美国临床实验室标准化委员会(NCCLS)推荐的M27-A法的结果进行比较。
结果PI、FUN-1和DiOC5(3)3种荧光染料均可用于FCM检测念珠菌的药物敏感性,其中PI、FUN-1均可用于FLC和AMB 2种药物的敏感性试验;与另外2种染料相比,利用PI染料进行检测的结果与M27-A法有更好的一致性,并且价廉易得,但其要求药物与细菌的孵育时间较另外2种染料长;DiOC5(3)仅可用于对AMB的最低抑菌浓度(MIC)测定,但其要求药物与细菌的孵育时间最短,只需0.5 h。
结论利用FCM进行抗真菌药物敏感性试验,可大大缩短检测时间,但为获得与M27-A法较为一致的结果,应针对不同的药物选用不同的染料,设定各自的最佳检测条件。
To develop a rapid flow-cytometric susceptibility testing of Candida species.
MethodsSixty Candida strains were tested for the susceptibility to fluconazole(FLC) and amphotericin B(AMB) by flow cytometry using propidium iodide (PI), FUN-1 and DiOC5(3) as indicator of viability. Flow cytometry results were compared with minimal inhibitory concentrations(MIC) determined according to the National Committee for Clinical Laboratory Standards (NCCLS) M27-A.
ResultsThree fluorescent probes could be used in flow-cytometric susceptibility testing of Candida species. PI and FUN-1 could be used in flow-cytometric susceptibility testing to FLC and AMB, but DiOC5(3) only used to AMB. An incubation time of 0.5 h of a.pngungal and yeast was shorter for DiOC5(3) than for the other probes. Compared with the other probes, the results of flow-cytometric susceptibility using PI showed better agreement with the NCCLS method and the cost was lower.
ConclusionsA.pngungal susceptibility testing by flow cytometry is a reliable, rapid method for determining susceptibility of Candida to FLC and AMB. However, it is crucial to choose different probes to different a.pngungal and establish the optimum testing conditions for obtaining consistent results with the NCCLS M27-A.
随着广谱抗菌药物的广泛使用, 临床上真菌感染的发生率逐年增加, 且真菌感染已成为免疫缺陷患者, 特别是获得性免疫缺陷综合征患者的主要致死原因。为获得快速准确的真菌药敏结果, 针对目前临床常用的抗真菌药物氟康唑(FLC)和两性霉素B(AMB), 我们选定了3种代表性染料, 即碘化丙啶(PI)、FUN-1和DiOC5(3), 采用流式细胞术(FCM)测定60株临床分离的真菌对这些药物的敏感性, 并与美国临床实验室标准化委员会(NCCLS)推荐的M27-A法的测定结果进行比较, 以建立一套结果与M27-A法基本吻合的快速检测抗真菌药物敏感性的方法。
1.菌株来源 60株菌株为2004年6月至2006年6月从宁波市第一医院临床标本中分离的念珠菌, 其中白念珠菌27株、热带念珠菌15株、近平滑念珠菌10株、葡萄牙念珠菌4株、季也蒙念珠菌2株、克柔念珠菌2株。
2.仪器和试剂 FLC(Pfizer公司), AMB(Sigma公司), PI(Sigma公司), FUN-1和DiOC5(3)(Invitrogen公司), 脱氧胆酸钠及马啉丙烷磺酸(MOPS)缓冲液(Amresco公司), RPMI 1640培养液(含谷氨酰胺)和叠氮钠(Sigma公司), 4-羟乙基哌嗪乙磺酸(HEPES)缓冲液(pH值7.2, Invitrogen公司), 沙氏葡萄糖琼脂(SDA)培养基和流式细胞仪(EPICS XL, Coulter公司)。
1.标准抗真菌药敏试验 参照NCCLS推荐的M27-A法[1], 即用RPMI 1640(含谷氨酰胺)对抗真菌药物FLC和AMB进行倍比系列稀释, FLC的终浓度为0.125~64 mg/L, AMB的终浓度为0.03~16 mg/L, 孵育时间为35 ℃ 48 h。最低抑菌浓度(MIC)的判断按照能抑制真菌生长的最低药物浓度进行。
2.FCM检测抗真菌药敏试验 参照参考文献[2, 3]方法, 选取在SDA培养基35 ℃生长24 h的菌落, 用RPMI 1640(含谷氨酰胺)调整细胞数至5× 105~1× 106 CFU/mL。分别加入终浓度为0.125~64 mg/L的FLC和终浓度为0.03~16 mg/L的AMB。经预试验, 确定了使用不同荧光染料时药物与真菌的最佳孵育时间及真菌与荧光染料的作用时间:用PI作荧光染料, FLC和菌株孵育时间需4 h, AMB需2 h; 用FUN-1作染料, 药物和菌株的孵育时间需1 h; 用DiOC5(3)作染料, 孵育时间仅需0.5 h。孵育结束后, 取300 μ L菌液, 加入等量的HEPES液(含2%葡萄糖, pH值7.2), 再分别加入不同的荧光染料PI(须同时加入终浓度为25 mmol/L脱氧胆酸钠)、FUN-1或DiOC5(3), 使其终浓度分别为1 mg/L、0.5 μ mol/L和0.5 μ mol/L, 轻拍混匀后, 室温下避光孵育, 孵育时间分别为10、30和5 min[3, 4]。同时选取未经任何药物处理的菌株作为阴性对照, PI染色的阳性对照用加热处理的菌株悬液, 结果判读时取平均荧光强度(MCF)较阴性对照增加50%以上的最低药物浓度作为MIC; FUN-1染色的阳性对照用经1 mmol/L叠氮钠孵育1 h的菌株悬液(叠氮钠可抑制FUN-1在真菌体内的代谢)[3], 选取MCF较阴性对照增加20%以上的最低药物浓度作为MIC; DiOC5(3)染色选取MCF较阴性对照减少3倍以上的最低药物浓度作为MIC。
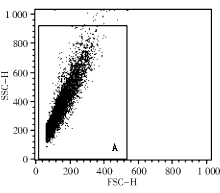
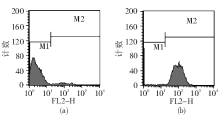
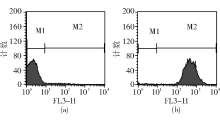
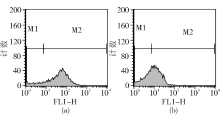
3.FCM检测 利用前向散射光(FS)-侧向散射光(SS)直方图, 选取低SS且低FS集中的菌株群作为分析对象, 见图1。PI的荧光强度在FL3(620 nm)直方图分析, FUN-1在FL2(575 nm)直方图分析, DiOC5(3) 在FL1(530 nm)直方图分析, 见图2~4。
| 表1 60株菌株M27-A法和FCM测定FLC的MIC结果比较 |
| 表2 60株菌株M27-A法和FCM测定AMB的MIC结果比较 |
在本研究中, 我们选择了3种不同作用机制的荧光染料, 其中FUN-1为膜渗透性染料, 可作为判断酵母真菌细胞存活性的指示剂。活细胞能处理FUN-1并将其浓缩至液泡, 从而产生红色的圆柱状液泡内结构, 而在死亡细胞, FUN-1滞留在胞液中, 呈现出弥散的黄绿色荧光, 不会出现红色的圆柱状液泡内结构 [3, 5]。DiCO5(3)为膜电位敏感的染料, 在完整的细胞内荧光强度大, 若药物的作用使细胞膜去极化可使其结合减少, 荧光减弱[6]。PI属膜非渗透性染料, 仅当胞膜受损后, 该染料才能进入细胞内与DNA结合, 因此活细胞的荧光强度很弱, 而死亡细胞荧光强度明显增加。因此, 在利用PI进行抗真菌药物的敏感性标记时, 由于药物与真菌的孵育时间短, 必须加入表面活性剂— — 脱氧胆酸钠来促进PI扩散到胞膜受损的真菌体内[7, 8]。
为在尽可能短的时间内获得与M27-A法较为一致的结果, 通过一系列的预试验, 并结合文献明确了采用不同染料时药物与真菌的孵育时间以及染色时间, 并以M27-A法结果为参照, 确定了不同染料进行FCM检测时MIC的判读标准。此外在预试验中发现, 未经药物处理的不同菌株与染料结合能力存在一定差异, 因此每株真菌均需采用自身作为阴性对照。
AMB属杀真菌剂, 其作用机制为通过与敏感真菌细胞膜上的固醇相结合, 损伤细胞膜的通透性, 导致细胞内重要物质如钾离子、核苷酸和氨基酸等外漏, 破坏细胞的正常代谢。FLC为氮杂茂类(azoles)抗真菌药物, 属抑真菌剂, 其作用机制主要为高度选择性干扰真菌的细胞色素P-450活性, 从而抑制真菌细胞膜上麦角固醇的生物合成。本研究结果显示, PI、FUN-1和DiOC5(3) 3种荧光染料均可用于FCM检测念珠菌对抗真菌药物的敏感性, 其中PI、FUN-1均可用于FLC和AMB 2种药物的敏感性试验, 与M27-A法有较为一致的结果; DiOC5(3) 用于FLC的敏感性试验时, 无论被检测真菌对FLC敏感与否, MCF均无明显变化, 推测FLC的作用机制对真菌膜电位影响较小, 因此该染料不适用于FLC的敏感性试验; 而DiOC5(3)用于对AMB的MIC测定时, 可获得与M27-A法较为一致的结果, 并且其要求药物与真菌的孵育时间最短, 只需0.5 h。与另外2种染料相比, PI染料进行检测的结果与M27-A法有更好的一致性, 并且价廉易得, 但其要求药物与真菌的孵育时间较另外2种染料长。
传统检测抗真菌药物的敏感性是通过浊度来判断的, 耗时长, 如NCCLS的M27-A法需48~72 h。因此, 利用FCM进行抗真菌药物的敏感性试验, 可极大地缩短检测时间, 及时为临床用药提供参考依据。但为获得与M27-A法较为一致的结果, 应针对不同药物选用不同的荧光染料, 并设定各自的最佳检测条件。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|