作者简介:岳保红,男,1968年生,博士,教授,主要从事白血病发病机制和实验诊断研究。
探讨体外沉默白血病细胞核干细胞因子(NS)基因转染后细胞形态学和细胞化学特征改变与细胞生物学行为的关系。
方法体外合成NS特异性短发夹状RNA(shRNA)转染HL-60白血病细胞,逆转录-聚合酶链反应(RT-PCR)和免疫印迹法评价NS基因沉默和NS蛋白合成抑制效果,倒置显微镜观察活体细胞形态,Wright-Giemsa染色观察细胞形态学改变,血液分析仪测定细胞大小、粒度和均一性变化,髓过氧化物酶(MPO)、α-乙酸萘酯酶(α-NAE)和过碘酸-雪夫反应(PAS)测定反映细胞化学特征变化。
结果沉默NS基因导致HL-60白血病细胞发生了形态学变化,细胞核和细胞质出现了进一步分化和成熟特征,Wright-Giemsa染色观察到细胞核碎裂现象,血液分析仪发现细胞变得大小不均并有较多核碎裂和无核的细胞碎片存在,细胞内定MPO、α-NAE酶活性和PAS反应增强。
结论沉默NS基因表达能促使HL-60细胞进一步分化、成熟,细胞形态学和细胞化学特征发生相应改变,这些形态学变化可以作为研究细胞生物学行为改变的依据之一。
To explore the effect of nucleostemin (NS) gene silencing on morphology and cytochemistry of HL-60 cells, so to study the relationship between the changes of morphology and cytochemistry and biological behaviors.
MethodsHL-60 cells were directly transfected by NS specific short hairpin RNA (shRNA). The effects of NS gene silencing and inhibition of NS protein synthesizing were detected by reverse transcription ploymerase chain reaction (RT-PCR) and Western blot. The morphology changes of HL-60 cells were observed by inverted microscope and Wright-Giemsa staining. The volume and granularity and size variation of HL-60 cells were assayed by blood cell analyzer. Myeloperoxidase(MPO), α-naphthol acetate esterase(α-NAE)and periodic acid-schiff (PAS) staining of HL-60 cells were analysed.
ResultsThe characters of differentiation and maturation in karyon and cytoplasm were observed by silencing NS gene in vitro. The nuclear fragmentations(karyorrhexises) showed in cells by Wright-Giemsa staining. The size variation of cells increased. The cells of small volume and karyorrhexises and cell-debrises without nucleus were found by blood cell analyzer. MPO and α-NAE activity and PAS positive rate increased after NS-shRNA transfection.
ConclusionsThe redifferentiation and maturation of HL-60 cells can be induced by silencing NS gene in vitro. Meantime, the characters of morphology and cytochemistry of HL-60 cells would be altered according to differentiation, and these changes of morphology and cytochemistry may be one of evidences which can show biological behaviors of cells.
核干细胞因子(nucleostemin, NS)是新发现的与细胞增殖相关的蛋白质, 在处于多潜能状态的干细胞和无限增殖能力的癌细胞表达, 已分化的成体细胞不表达NS[1~5]。NS蛋白可能是维持干细胞和癌细胞增殖所必须的蛋白质并使细胞保持在不分化状态。对于干细胞和肿瘤细胞共有的NS蛋白功能及其调控作用进行研究意义重大[6, 7], 目前有关NS与干细胞演变和肿瘤细胞的发生、发展的作用研究国内外才刚刚起步。
白血病是造血干细胞(HSC)的恶性克隆性疾病, 造血细胞被遏制在某个阶段不能分化、成熟并处于无限增殖状态。我们先前的研究证实白血病细胞存在NS基因及产物高表达现象[8], 进一步的研究发现沉默NS基因可以减弱白血病细胞的增殖能力、诱发细胞凋亡、促使白血病细胞重新分化, 在此过程中伴随着白血病细胞形态学和细胞化学特性的改变。
HL-60细胞购自中科院上海细胞所, 在含10%胎牛血RPMI1640培养液中悬浮培养(含青霉素100 U/mL、链霉素100 μ g/mL), 条件为饱和湿度、37℃和5%CO2浓度。
1.设计 从人类NS基因的3个变异体(Varriant, NM014366, NM206825, NM206826)cDNA中找出3者的共同序列1 833 个碱基。按照小干扰RNA(siRNA)序列设计原则, 剔除掉与其他编码序列或表达系列标签(EST)同源的序列, 最终选取2个21 bp序列作为合成shRNA的对应序列, 中间加上Loop环aaguucucu 9个碱基, 3'末端是2个突出的“ UU” , shRNA序列全长为49 bp。
2.合成 首先构建含T7启动子序列的用于体外合成NS-shRNA的互补DNA模板单链, 退火后形成模板双链, 在T7 RNA聚合酶(Promega公司)作用下的合成2条NS-shRNA, 选取沉默NS-mRNA作用强的1条进行后续实验。
取对数生长期细胞调浓度为4× 105/μ L, 随机分为转染组、阴性对照组和空白对照组, 每组500 μ L细胞悬液于24孔板。转染方法:125 μ L无血清培养基加入2 μ L Code Break siRNA转染试剂(Promega公司), 转染组加NS-shRNA, 根据预实验选择终浓度为10 nmol/L, 阴性对照组加无关shRNA序列, 空白对照组加生理盐水和转染试剂。
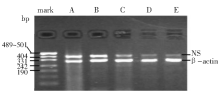
NS-shRNA转染HL-60细胞72 h后, 收集转染组、阴性和空白对照组细胞分别提取mRNA和总蛋白, 进行逆转录-聚合酶链反应(RT-PCR)和免疫印迹法(一抗购于美国R& D公司, 二抗和显色系统购于北京中杉金桥生物技术有限公司)。NS基因引物上游:5'-AAAGCCATTCGGGTT GGAGT-3; 下游:5'-ACCACAGCAGTTTGGCAGC AC-3', 产物为418 bp。以β -actin基因为内参, 引物上游:5'-TCCTGTGGCATCCACGAAACT-3'; 下游:5'-GAAGCATTTGCGGTGGACGAT-3', 产物为315 bp(以上引物由上海生工生物工程技术服务有限公司合成)。
转染组及对照组细胞培养48 h后倒置显微镜下观察培养板内活体细胞生长状态, 然后分别用K4500型(Sysmex公司)和SF3000型(Sysmex公司)血液分析仪测定细胞体积(volume)、细胞粒度(granularity)和均一程度的变化情况。72 h后收集细胞, 500 r/min(离心半径为18 cm)离心浓缩细胞涂片, 参照文献[9]进行Wright-Giemsa染色, 显微镜下观察细胞形态和核形改变。
将转染组及对照组细胞培养24、48、72 h后分别收集细胞, 离心浓缩后涂片, 参照文献[9]进行MPO染色、α -NAE染色和NaF抑制试验和PAS染色(上海太阳生物技术有限公司试剂盒), 显微镜下观察、计数阳性细胞数。
用SPSS10.0软件进行显著性检验, 检验水准α =0.05, 均数以
1.NS基因沉默效果测定结果 NS-shRNA转染HL-60细胞24 h NS-mRNA的表达水平有所减弱, 即有部分NS-mRNA表达被阻断, 以转染48 h和72 h的NS-mRNA表达阻断效果最明显, 阻断率最高达71.88%, 48 h和72 h之间相比差异无统计学意义(t=0.98, P> 0.05)(图1)。
2.NS蛋白抑制程度测定结果 免疫印迹法显示转染组NS蛋白电泳条带与空白和阴性对照组相比变细、变浅。灰度分析:与空白对照组相比, NS蛋白抑制率为78.2%。说明NS-shRNA阻断NS-mRNA表达后, 导致细胞内NS蛋白合成量明显减少。见图2。
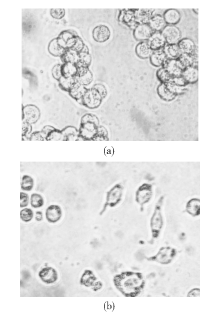
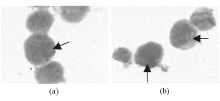
1.活体细胞形态变化 对照组HL-60细胞呈聚集性悬浮生长, 细胞大小较均一, 光滑圆润。经NS-shRNA作用48 h后, 细胞密度和聚集程度下降, 呈单个散在生长, 细胞之间大小相差悬殊, 一部分细胞由圆形变成了梭形并有明显的伪足。见图3。
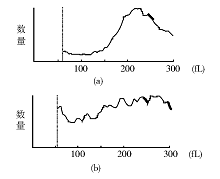
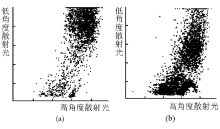
2.细胞大小和均一程度改变测定结果 血液分析仪测定对照组HL-60细胞体积大小均一, 体积直方图上显示220 fL附近为峰值, 曲线近似正态分布, 低于150 fL的细胞很少; NS-shRNA转染48 h后HL-60细胞峰值和正态分布曲线消失, 低于150 fL的细胞大量存在, 细胞之间大小悬殊。见图4。散点图显示:对照组HL-60细胞只有1个高密度散点聚集区, 转染组存在2个高密度散点聚集区。纵坐标的“ 低角度散射光(LASL)” 值与细胞大小正相关, 转染组其“ 重心” 下移, 说明有较多小体积HL-60细胞; 横坐标的“ 高角度散射光(HASL)” 值与细胞核大小和胞内颗粒多少呈正相关, 其“ 重心” 左移, 说明存在较多核碎裂细胞和无核的细胞碎片。见图5。
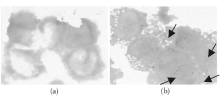
3.Wright-Giemsa染色细胞形态观察 对照组胞体较大, 大小一致, 多呈圆形或椭圆形; 核大而圆, 占3/4面积以上, 染色质细致, 含1~4个明显的核仁; 细胞质少, 染深蓝色, 可见聚集分布的紫红色颗粒和数个泡沫样空泡。见图6(a)。转染组胞体大小不均, 部分细胞呈不规则形, 带有伪足。胞体小的细胞核紧缩, 染色质浓集, 核仁不清或消失。见图6(b)。并出现核碎裂现象和大小不等的带有核碎裂物质的细胞碎片, 部分核出现凹陷。见图6(c)。
1.髓过氧化物酶(MPO)测定结果 NS-shRNA转染作用HL-60细胞48 h后MPO阳性率比对照组高(t=4.553, P< 0.01), 至72 h继续升高, 与对照组比较差异有统计学意义(t=16.997, P< 0.001)。但在转染的最初的24h内MPO与对照组相比没有明显变化(t=0.323, P> 0.05)。见图7、表1。
| 表1 NS-shRNA转染后HL-60细胞MPO阳性率变化(%) |
2.α -NAE测定结果 对照组HL-60细胞α -NAE染色呈阴性反应, 经NS-shRNA作用72 h后, 出现了13.0%的阳性细胞, 胞质内出现棕黑色产物(图8b), NaF能抑制该阳性反应。说明经过NS-shRNA的作用出现了一些单核细胞性质的α -NAE(图8c)。
3.PAS反应测定结果 对照组HL-60细胞PAS反应呈阴性, 经NS-shRNA作用72 h后, 出现了72%的阳性细胞, 阳性物质为紫红色块状或颗粒状。见图9。
NS基因表达下调可导致细胞离开细胞增殖周期而发生分化[10~13]。沉默NS基因诱导HL-60细胞重新分化, 细胞形态学特征和细胞化学染色也有相对应的表现, 转染后的HL-60细胞活体和Wright-Giemsa染色观察发现一小部分从圆形变成了梭形和长尾形, 细胞内出现了单核细胞性质的α -NAE, 这类细胞的数量和流式细胞仪(FCM)测到的CD14阳性细胞数相吻合, 说明确实有向单核细胞方向的分化。连续观察发现被转染的HL-60细胞内MPO一直在增加, 说明一部分向粒细胞方向进一步成熟。PAS反映出细胞内糖原类物质增多, 也说明HL-60细胞在NS基因表达减少后有进一步分化、成熟倾向。Wright-Giemsa染色显示细胞核缩小、凹陷, 核染色质紧密, 出现嗜酸性胞质。综合分析说明沉默NS基因有促使HL-60细胞进一步分化和成熟的作用。并且分化抗原显示是向粒细胞系和单核细胞系的多向分化。本研究借助血液分析仪对HL-60白血病细胞进行了大小、粒度和均一性分析, 该类仪器虽然不是专用研究设备, 但也能对个体细胞的外部甚至内部特征进行有效的分析, 反映出细胞的差异, 得到了有价值的数据。细胞大小和粒度分析结果说明NS-shRNA转染后培养体系中出现了许多小体积细胞、小细胞核和细胞碎片, 同时Wright-Giemsa染色后显微镜下观察到细胞核碎裂, 用dUTP缺口末端标记(TUNEL)技术进一步证实这个过程中有早期凋亡事件发生, 出现的核碎裂可能是沉默NS基因诱发了HL-60细胞发生凋亡。
NS蛋白目前认为可能是决定干细胞和癌细胞穿越G2/M检查点的特异性调控因子, 能与p53蛋白结合, 通过和野生型p53蛋白的动态结合与分离来影响p53发挥功能[1]。本研究用的模型HL-60细胞是p53缺失型的, 但沉默NS后也同样引起了一系列细胞生物学改变。Jafarnejad[14]的最新研究报告也指出NS影响细胞的增殖与分化未必都依赖与p53相互作用。由此推断NS蛋白p53关系并不是那么简单, 可能还有一些中间环节甚至第二条途径来影响细胞的一系列活动。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|