作者简介:王 蓉,女,1968年生,学士,主管技师,主要从事免疫、细菌专业工作。
建立β-D-半乳糖苷酶(GAL)自动化分析方法。
方法用2-氯-4-硝基苯基-β-D-半乳糖苷(CNP-GAL)为底物,在pH值4.8柠檬酸-柠檬酸钠缓冲体系下,在405 nm处测定产物吸光度值的变化,得出GAL活性。用此方法检测了58名正常体检者及88例患者(包括急性肾功能衰竭15例、尿毒症32例、糖尿病肾病18例、高血压肾病23例)的GAL水平。
结果本方法最适pH值为4.8,基质浓度为2.5 mmol/L。批内、批间平均变异系数( CV)分别为3.44%、5.17%。米氏常数(Km)为0.45 mmol/L。正常对照组GAL中位数(范围)为6.2(4.8~7.8) U/gCr,急性肾功能衰竭组为190(74.2~285.6) U/gCr,尿毒症组为39.6(8.9~161.0) U/gCr,糖尿病肾病组为11.3(5.5~67.0) U/gCr,高血压肾病组为16.1(4.1~137.5) U/gCr,与正常对照组比较差异均有统计学意义( P<0.001、 P<0.05)。
结论该法简便、快捷、精确,可用于自动化分析,并且留样方便,适宜临床常规应用。GAL可作为评价肾小管疾病及肾实质性疾病的一项指标。
To establish a kinetic monitoring assay for detecting β-D-galactosidase (GAL).
Methods2-chloro-4-nitropheny1-β-D-galactosaminide(CNP-GAL) was used as substrate. GAL could catalyze the substrate to produce CNP in citric acid-citrate buffer (pH 4.8). The activity of GAL could be obtained through determining the product at 405 nm.The GAL activity in 58 healthy controls and 88 patients(15 with acute kidney functional debility,32 with uremia, 18 with diabetic nephropathy, 23 with hypertension nephropathy) was determined by this mothed.
ResultsThe optimum pH of the mothed was 4.8 and substrate concentration was 2.5 mmol/L. Intraassay CV was 3.44% and interassay CV was 5.17%. Km was 0.45 mmol/L. The GAL activity in healthy controls was 6.2(4.8~7.8) U/gCr, in acute kidney functional debility patients was 190.0(74.2~285.6) U/gCr, in uremia patients was 39.6(8.9~161.0) U/gCr, in diabetic nephropathy patients was 11.3 (5.5~67.0) U/gCr, in hypertension nephropathy patients was 16.1(4.1~137.5) U/gCr. There was a significant difference between patients and control group ( P<0.001, P<0.05).
ConclusionsThe method is simple, rapid, accurate, and suitable for automatic analysis of GAL. It could be an index for evaluation of renal diseases.
β -D-半乳糖苷酶(β -D-galactosidase, GAL)属溶酶体水解酶, 主要来源于肾小管近端上皮细胞, 可从尿中直接排出。尿中N-乙酰β -D氨基葡萄糖苷酶(NAG)和GAL同属溶酶体酶, 也来自肾小管上皮细胞, 二者用于尿酶谱的分析有利于各种肾损害的诊断及预后观察[1]。以往GAL的测定方法大多数为荧光法、终点法[2], 这些方法有的因受设备限制, 推广难度较大; 或因操作复杂, 影响因素多, 而影响进一步推向临床应用。我们应用上海交通大学医学院化学教研室合成的底物, 建立了GAL的动力学测定方法, 初步应用于临床, 并且联合检测了尿液NAG及α 1-微球蛋白(α 1-MG)、微量白蛋白(mAlb)。
正常对照组为上海市第二人民医院健康体检者, 共58名, 男30名, 女28名, 年龄18~68岁。病例组共88例, 包括急性肾功能衰竭15例、尿毒症32例、糖尿病肾病18例、高血压肾病23例, 年龄35~76岁。
1.仪器 HITACHI 7150全自动生化分析仪; 德灵BN-100特定蛋白仪。
2.试剂 (1)GAL底物:2.5 mmol/L 2-氯-4-硝基苯基-β -D-半乳糖苷(CNP-GAL)溶液, 称取CNP-GAL(相对分子质量为335.71)83.9 mg, 溶于100 mL 0.1 mol/L柠檬酸缓冲液(pH值4.8)中, 避光4 ℃保存; (2)NAG试剂:由上海太阳生物技术有限公司提供; (3)α 1-MG、mAlb试剂:由德灵公司提供; (4)尿肌酐(Cr)试剂:由世诺临床诊断制品(上海)贸易有限公司提供。
3. GAL测定原理 GAL催化底物CNP-GAL水解生成黄色的2-氯-4-硝基酚, 通过测定2-氯4-硝基酚在405 nm处吸光度(A)值上升的速度可计算出GAL的活性。以每升尿液水解CNP-GAL生成CNP的μ mol/min数为一个活性单位(U/L)。为消除尿量对酶浓度的影响, 测定结果以酶活性值与同一样本尿Cr(g/L)的比值(U/gCr)报告。
4. GAL测定方法 (1)参数:波长405 nm; 温度37 ℃, 尿液20 μ L, 试剂180 μ L, 延迟时间60 s, 测定时间120 s, 测定方式为连续监测法, K值为5 068; (2)计算:GAL(U/L)=Δ A/min×
5. 其他项目测定方法 NAG为终点比色法; α 1-MG、mAlb 为散射比浊法; 尿Cr为酶反应法。
应用SPSS15.0统计软件。测定结果呈正态分布的用
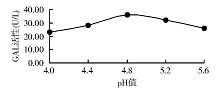
1.酶促反应最适pH值 基质浓度固定为2.5 mmol/L, 配置pH值4.0~5.6的缓冲液。同时与1份样本作用, 结果pH值4.8时酶活性最高。见图1。
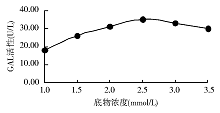
2.最适底物浓度 在pH值4.8条件下, 分别用1.0~3.5 mmol/L底物测定1份样本。反应曲线显示, 最适底物浓度为2.5 mmol/L。见图2。
3.缓冲液选择 经比较发现, 使用醋酸缓冲液及磷酸氢二钠-柠檬酸钠缓冲液GAL活性较低, 而柠檬酸缓冲液较适合, 见表1。
| 表1 3种缓冲液测定酶活力的比较 |
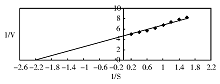
4.米氏常数(Km)测定 不同浓度的底物对反应的影响由1/[V]对1/[S]绘制Linenear-Buk图。从图中得出-1/Km=-2.22。GAL对底物的Km为0.45 mmol/L。见图3。
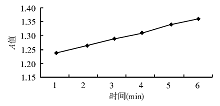
5.酶促反应连续监测时间确定 取酶活性为61.8 U/L的样本进行测定, 每12 s读取1次A值直至10 min。发现1~6 min时, A值呈线性, 故定延迟时间为60 s, 测定时间为120 s。数据经统计学处理, r=0.997 0, 见图4。
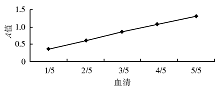
取一管酶活力为59.9 U/L的标准酶, 用缓冲液按1/5~5/5比例稀释测定, 结果显示A值变量与稀释度呈线性。见图5。
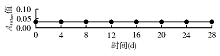
取1份新鲜尿液分30份放入-30 ℃低温冰箱中, 每天取1份测定其活性。结果发现30 d内酶活力无明显变化。
正常对照组及肾脏疾病患者尿GAL、NAG、α 1-MG、mAlb测定结果见表3。急性肾功能衰竭组、尿毒症组、高血压肾病组及糖尿病肾病组GAL活性均高于正常对照组(P< 0.001, P< 0.05)。
| 表3 肾脏疾病尿NAG活性及尿α 1-MG含量变化 |
GAL来源于肾小管上皮细胞, 存在于新生态溶酶体中, 在肾实质损害的不同类型中呈不同程度的变化。因此测定GAL有一定的临床意义。
本研究发现, 测定GAL的最适pH值为4.8, 最适底物浓度为2.5 mmol/L, 采用0.1 mol/L柠檬酸缓冲液时酶活性最高。Km为0.45 mmol/L。批内、批间平均CV分别为3.44%、5.17%。新鲜尿液置-30℃低温冰箱中保存30 d, 酶活力无明显变化。新鲜配置试剂放置4 ℃冰箱, 避光保存4周稳定性良好。
据文献[3]报道, NAG及α 1-MG的检测对于早期肾小管损伤的诊断、尿mALb对于肾小球的损伤如糖尿病肾病的早期诊断具有重要的意义。本研究显示, 急性肾功能衰竭组、尿毒症组、高血压肾病组及糖尿病肾病组GAL活性均高于正常对照组(P< 0.001, P< 0.05)。从测定成本来考虑, α 1-MG要比GAL高, 并且需要特定蛋白分析仪, 而测定GAL采用的是动力学法。该法简便、快捷、精确, 无需设空白、可用于自动化分析仪、并且留样方便, 适宜临床常规应用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|