作者简介:沙 丹,女,1983年生,硕士,主要从事微生物检验研究。
建立快速检测沙门菌、变形杆菌和金黄色葡萄球菌的多重聚合酶链反应(PCR)方法。
方法本研究依据沙门菌侵袭基因正调节蛋白(hilA)基因、变形杆菌溶血素(hpmA)基因和金黄色葡萄球菌特异性pSa-442序列,运用Primer Premier 5.0分别设计3对特异性引物,预计PCR扩增的目的基因片段分别为为580 bp、401 bp、256 bp。通过对单管多重PCR扩增的特异性、敏感性分析以及建立L16(43)正交试验对单管多重PCR扩增条件如引物浓度、dNTP浓度和Tm值等的优化,建立了快速同时检测3种食源性致病菌的单管多重PCR方法。
结果该方法检测的灵敏度分别为:94.07 pg沙门菌DNA,140.85 ng变形杆菌DNA,1.41 ng金黄色葡萄球菌DNA。模拟检测食品中的混合3种菌,4 h培养后样品的最低检测限度分别为:沙门菌100 菌落形成单位(CFU)/mL、变形杆菌101 CFU/mL、金黄色葡萄球菌100 CFU/mL。
结论该方法特异性和灵敏度高,检验周期短,可用于对食品中多种致病菌的快速诊检和监控。
To establish a multiplex polymerase chain reaction (PCR) assay for simultaneous detection of Salmonella spp., Proteus mirabilis and Staphylococcus aureus.
MethodsThree pairs of primers have been designed according to the hilA of Salmonella spp., hemolysin(hpmA) of Proteus mirabilis and Staphylococcus aureus clone pSa-442 Sau3AI fragment and the anticipated PCR products were 580bp, 401bp and 256bp. A multiplex PCR method has been developed for dignosing Salmonella spp., Proteus mirabilis and Staphylococcus aureus, after analysis for specificity and sensitivity and optimization of reaction condition by orthogonal experimental design L16(43).
ResultsThe sensitivity of multiplex PCR was 94.07 pg genome DNA for Salmonella spp., 140.85 ng for Proteus mirabilis and 1.41 ng for Staphylococcus aureus. Simulation experiment showed that the minimum detection limit after cultivation for 4 hours was 100 CFU/ml for Salmonella spp., 101 CFU/ml for Proteus mirabilis and 100 CFU/ml for Staphylococcus aureus.
ConclusionsA rapid, specific and sensitive multiplex PCR system has been established and it is valuable for exploration and appliacation.
沙门菌、变形杆菌和金黄色葡萄球菌是食品污染的常见致病菌, 主要通过食品、饮水感染人类, 导致细菌性食物中毒、肠热症、败血症等, 甚至死亡。根据国家食源性疾病监测网的统计资料显示, 近年来在我国由微生物引起的食源性疾病事件中, 沙门菌、变形杆菌和金黄色葡萄球菌分别占:17.19%、14.10%和8.19%, 是最常见和最主要的病因物质[1]。因此, 快速检测食品和水样中的致病菌对于预防和控制这些疾病的发生和流行至关重要。
为了改善传统的细菌培养鉴定方法操作繁琐、检验周期长且灵敏度也较低的不足, 本研究使用沙门菌的hilA基因、变形杆菌的hpmA基因、金黄色葡萄球菌的特异性pSa-442序列[2~4]作为研究对象, 建立了可同时检测3种病原菌的单管多重酶链聚合反应(PCR)方法, 并对其在食品检测方面的应用进行了初步的探讨。
10株标准菌株, 其中沙门菌ATCC 50073, 志贺菌ATCC 51334由国家菌种保藏中心提供, 奇异变形杆菌ATCC 12453, 金黄色葡萄球菌ATCC 6538, 副溶血性弧菌ATCC 17802, 单核增生李斯特菌ATCC 13932, 腊样芽孢杆菌ATCC 11778, 小肠结肠耶尔森菌ATCC 23715, 空肠弯曲杆菌ATCC 33291, 乙型溶血性链球菌ATCC 19615购自美国MBL公司; 霍乱弧菌O139基因组核酸由江苏省疾病预防控制中心惠赠; 大肠埃希菌O157为本室保存菌株。
Ex Taq酶、100bp DNA Ladder Marker购自TaKara宝生物工程(大连)有限公司, GoldviewTM染料购于上海赛百盛基因技术有限公司, Mastercycler梯度PCR仪为Eppendorf公司产品, 电泳仪为Bio-Rad公司产品, 凝胶成像仪购自上海天能公司。
根据沙门菌的hilA基因、变形杆菌的hpmA基因和金黄色葡萄球菌特异性pSa-442序列, 应用Primer Premier 5.0分别设计如下3对特异性引物(表1)。
| 表1 沙门菌、变形杆菌及金黄色葡萄球菌的多重PCR引物 |
取斜面菌落于100 μ L裂解液的离心管中, 充分混悬菌体后置100℃金属浴中煮沸15 min, 12 000 r/min离心1 min, 将上清转移至干净的无菌微量离心管中, 即为细菌的总DNA溶液, -20℃保存备用。
PCR反应总体积为25 μ L, 其中MgCl2浓度1.5 mmol/L, dNTP浓度200 μ mol/L, 沙门菌、变形杆菌和金黄色葡萄球菌的引物终浓度均为50 nmol/L, Ex Taq酶1.0U。PCR反应参数:94℃ 5 min× 1; 94℃ 40 s, 55℃ 40 s, 72℃ 90 s, 35个循环; 72℃ 延伸至5 min。PCR产物于15 g/L的琼脂糖凝胶上进行电泳。
分别设计L16(43)正交试验, 对影响多重PCR结果的扩增条件如Mg2+浓度、引物浓度、dNTP浓度、退火温度等进行优化, 以确定最佳的PCR反应条件。
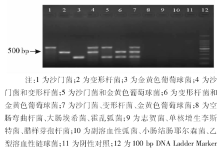
1. 特异性试验 分别将提取的沙门菌、变形杆菌、金黄色葡萄球菌的DNA模板两两混合, 按已优化的多重PCR反应条件进行扩增, 验证多重PCR反应体系的特异性, 为进一步验证多重PCR的非特异性, 分别以该反应体系对志贺菌、副溶血性弧菌、单核增生李斯特菌、腊样芽孢杆菌、小肠结肠耶尔森菌、空肠弯曲杆菌、乙型溶血性链球菌、霍乱弧菌、大肠埃希菌等非目的菌进行PCR扩增。
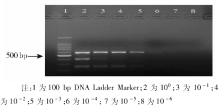
2. 敏感性试验 将已测定浓度的沙门菌、变形杆菌、金黄色葡萄球菌的模板DNA按100~10-6梯度进行10倍稀释后分别混合, 按优化的多重PCR反应条件分别进行PCR扩增, 测定多重反应体系的敏感性。
分别制备浓度为108 CFU/mL的沙门菌、变形杆菌和金黄色葡萄球菌的菌悬液, 将3种菌培养液任意2种、3种等量混合加入到3种菌阴性的熟猪肉中。使用无菌营养肉汤对制备好的模拟肉污染样品进行10倍梯度稀释, 分别取1 mL菌液提取核酸并计算各管的菌落总数。将剩余的样品悬液放入水浴振荡培养箱中37℃振荡培养4 h后, 每管取1 mL菌液提取核酸制成样品4 h培养后的DNA模板, 分别对提取的核酸进行多重PCR分析, 比较样品培养前和样品4 h培养后的PCR检测灵敏度。
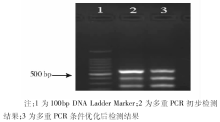
初步条件下在同一试管中可同时扩增得3种目的基因片段, 15 g/L琼脂糖凝胶电泳显示在580 bp、401 bp和256 bp处有3条明显的条带存在。对PCR结果影响较大的因素:Mg2+浓度、dNTP浓度、引物浓度、退火温度及酶浓度等, 分别设计在一定范围内的L16(43)正交试验对反应体系进行优化。优化后的25 μ l反应体系中各试剂终浓度为:MgCl2 2.0 mmol/L, dNTP 150 μ mol/L, 沙门菌、变形杆菌和金黄色葡萄球菌的引物终浓度分别为:60 nmol/L、100 nmol/L、160 nmol/L, Taq DNA聚合酶1.0 U。PCR反应参数:94℃ 5min× 1; 94℃ 40 s, 55℃ 40 s, 72℃ 90 s× 35; 72℃ 延伸至5 min(图1)。
分别以沙门菌、变形杆菌、金黄色葡萄球菌的单一DNA、两两混合DNA及3种菌的混合DNA为模板, 按优化的三重PCR反应体系进行扩增, 结果显示在相应的580 bp、401 bp和256 bp处出现了明显的特异性目的条带, 且无非特异性条带和引物二聚体的形成, 9种非目的菌对多重PCR反应体系的非特异性检测结果显示均无明显的非特异性扩增出现, 本反应体系与非目的致病菌不会产生明显的交叉反应(图2)。
多重PCR最低能检测到反应体系中94.07 pg的沙门菌DNA, 140.85 ng的变形杆菌DNA, 1.41 ng的金黄色葡萄球菌DNA(图3)。
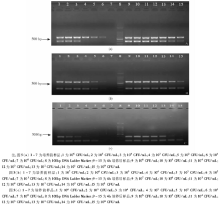
1. 3种菌混合培养样品的灵敏度检测
将含有等量沙门菌、变形杆菌和金黄色葡萄球菌的模拟肉污染样品振荡培养4h, 分别提取培养前和培养后的样品核酸进行多重PCR检测。结果显示:4h培养后样品中3种细菌的检测灵敏度显著高于培养前样品, 将可检测到的最高稀释浓度作为多重PCR在样品中的最高检测灵敏度, 则培养前可检测的最高稀释度为10-4, 即可检测到的3种菌的浓度分别为:沙门菌102菌落形成单位(CFU)/mL、变形杆菌103 CFU/mL、金黄色葡萄球菌102 CFU/mL, 培养后可检测的最高稀释度为10-6, 可检测到的3种菌的浓度分别为:沙门菌100 CFU/mL、变形杆菌101 CFU/mL、金黄色葡萄球菌100 CFU/mL(图4)。
2. 2种菌混合培养样品的灵敏度检测
分别将沙门菌与变形杆菌、沙门菌与金黄色葡萄球菌及变形杆菌与金黄色葡萄球菌的模拟肉污染样品振荡培养4 h, 分别提取培养前和培养后的样品核酸进行多重PCR检测。结果显示:3种模拟样品经4 h培养后所含2种细菌的检测灵敏度均较培养前有显著提高。沙门菌与变形杆菌混合模拟样品培养前的灵敏度为:沙门菌101 CFU/mL、变形杆菌104 CFU/mL, 4 h培养后可检测到的2种菌的浓度为:沙门菌100 CFU/mL、变形杆菌100 CFU/mL[图5(a)]。沙门菌与金黄色葡萄球菌混合模拟样品培养前的灵敏度为:沙门菌102 CFU/mL、金黄色葡萄球菌102 CFU/mL, 4 h培养后可检测到的2种菌的浓度分别为:沙门菌101 CFU/mL、金黄色葡萄球菌101 CFU/mL[图5(b)]。变形杆菌与金黄色葡萄球菌混合模拟样品培养前的灵敏度为:变形杆菌104 CFU/mL、金黄色葡萄球菌101 CFU/mL, 4 h培养后可检测到的2种菌的浓度分别为:变形杆菌101 CFU/mL、金黄色葡萄球菌100 CFU/mL[图5(c)]。
多重PCR是在常规PCR基础上改进并发展起来的一种新型PCR扩增技术, 可同时检测多种病原微生物, 具有高效、高产、低成本、速度快等优点, 目前已在多种病原微生物的检测中得到初步的应用[5, 6], 是食源性致病菌快速检测技术的方向。
目的基因的筛选对PCR的特异性非常重要。本研究选取的沙门菌hilA基因、变形杆菌hpmA基因和金黄色葡萄球菌特异性pSa-442序列均为目的菌的高度保守序列, 特异性强, 可作为基因检测和鉴定的依据[2~4]。这也在本实验中得到了进一步的证实。
多重PCR的影响因素复杂, 不同的引物之间、模板和引物浓度及其比例、Mg2+的浓度、dNTP的浓度、Tm值的大小等都会对PCR结果造成不同程度的影响。本研究通过设计在一定范围内的L16(43)正交试验优化了多重PCR反应体系, 研究表明在本反应体系中对扩增结果影响较大的是Mg2+浓度和3种引物的浓度, 而酶浓度和Tm值在一定范围内的变化不会对结果有显著的影响。
本研究对任意2种、3种菌混合的模拟肉污染样品进行多重PCR检测, 比较样品培养前和4h培养后的检测灵敏度, 结果表明模拟样品经4h振荡培养后, 多重PCR体系的检测灵敏度将得到显著的提高, 这有助于突发公共卫生事件中样品快速检测结果的准确性, 也极大地减少了实际工作中因混合菌生存状态的差异而引起的检测假阴性出现的机率。有报道表明, 大多数致病菌的感染计量都大于103 CFU/mL[7], 本研究所建立的多重PCR体系的检测灵敏度下限低于致病菌的最低感染计量, 因此对致病菌的监测具有重要的意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|