作者简介:李 卿,男,1981年生,硕士,主要从事细菌耐药性研究。
通讯作者:蒋燕群,联系电话:021-64369181-8848。
质粒编码AmpC酶绝大多数呈持续高表达, 只有少数有诱导性, 如DHA-1, DHA-2, DHA-3, CMY-13, ACT-1, CFE-1。诱导现象产生的原因在于含有调控基因, 且他们能正常行使功能。研究诱导机制不仅有助于深入了解细菌耐药性产生的原因, 还可以为临床用药、控制耐药特性播散和新药开发等提供借鉴。我们将从调控机制及其临床意义方面研究进展做一综述。
分析DNA序列, 除了可用于了解调节基因的同源性外, 还有助于进一步明确位点突变与诱导表型的关系。调控基因转录水平通过RNA产率和半衰期来反映, 并且RNA转录后修饰也提示ampC基因表达存在转录后水平调控[1]。调节蛋白是调节功能的执行者, 他们的作用过程及结果受其结构影响, 包括氨基酸序列、活性中心和突变热点等[2]。以下简述主要调节基因的研究进展。
1. ampR ampR基因存在与否是ampC基因表达有无诱导性的决定因素, 可诱导的质粒ampC基因同位于染色体上的一样, 一定含有与ampC毗邻的ampR且其编码产物功能正常。ampR起诱导作用的前提是构成ampR-ampC结构, 其中ampR紧邻ampC, 并位于其上游, 与ampC呈逆向转录, 并且启动子有部分重合(图1[3])。AmpR蛋白属于Lys调节蛋白家族, 很多Lys家族成员都可作为转录激活因子激活靶基因同时抑制自己的表达[4]。目前已有实验证明, 这种自我表达抑制并非通过抑制自身的启动子来实现[5, 6], 具体机制还有待阐明。ampR的表达是组成性的低表达, 不论有无诱导剂的存在。
可见, 诱导ampC基因表达不是通过增加ampR基因表达造成, ampR基因不是通过增加其产物的量来激活ampC基因[7]。 AmpR蛋白通过结合或解离ampC启动子来调节ampC基因转录, 即AmpR蛋白与ampR-ampC基因间区结合, 干扰DNA依赖的RNA聚合酶(DDRP)启动ampC基因转录[8], 组成性抑制ampC基因表达; 诱导剂作用下, AmpR蛋白解除抑制同时激活ampC表达。也有研究发现, AmpR有全局调控的作用, 除了调节AmpC表达外, 还可影响其他β 内酰胺酶(如PoxB)和毒力因子表达[6]。
2. ampD ampD基因的调控作用依赖于正常ampR-ampC结构的存在。ampD编码N-乙酰葡萄糖胺-L-丙氨酸裂解酶, 即AmpD蛋白, 作用是切断 N-乙酰胞壁酸与L-丙氨酸之间的酰胺键, 释放糖和多肽。AmpD对ampC表达的影响是间接的, 既不是直接结合AmpR或DNA, 也不是作用于β 内酰胺类药物, 而是通过参与细胞壁肽聚糖的代谢循环来调节ampC表达。许多不可诱导的革兰阴性菌中, 也可见到ampD, 如肺炎克雷伯菌, 大肠杆菌等[9]。结构上讲, AmpD 有2个重要的结合位点:锌离子结合口袋和底物结合位点。ampD基因特定位点突变可以导致不同的AmpC诱导表型, 如半组成性去阻遏型, 完全去阻遏型, 高诱导型和温度敏感型[2]。这种AmpD结构变异多发生在AmpD羧基末端的4个氨基酸序列及其组成上。可见该段序列对于保持AmpD功能完整性具有重要意义。虽然ampD序列在不同菌种间存在一定的差异, 但有学者发现某些菌种之间的AmpD在导入彼此的菌体后, 仍然可以起作用[10]。进一步讲, 种间ampD的差异性究竟在ampC表达中起到多大作用, 最近有学者尝试构建ampD模型来研究这一问题[9]。
3. ampG AmpG蛋白是位于胞质膜上的通道蛋白, 诱导过程中的信号分子(肽聚糖代谢产物)通过AmpG基因进入胞质内。Korfmann等[8]研究表明ampG是ampR激活ampC所必须的, 如果没有ampG, ampC就谈不上诱导和持续高水平的表达。这些代谢产物只有通过AmpG才能进入胞质[11]。随着研究深入, 发现AmpG的转运是非选择性的, 即N-乙酰葡糖胺-N-乙酰胞壁酸-三肽, 四肽和五肽都可以通过[11]。
4. ampE 80年代末, 有学者提出ampE基因产物AmpE蛋白作为跨膜信号转导蛋白, 同时参与AmpC表达的调控[12]。但是也有研究认为ampE不参与诱导过程[2], 因为仅ampE失活并不会导致ampC的表达异常, 近来有报道进一步证实了这一说法, 并且提出AmpE作为ampDE操纵子的编码产物, 其作用与AmpD密切相关[13]。
研究质粒ampC表达的诱导性的基础之一, 就是质粒ampC与染色体ampC的诱导表达共用同一调节系统, 比如染色体编码的AmpD蛋白也可阻抑质粒ampC的表达, 质粒ampC转移至不含染色体ampC的菌种后使该菌产生可诱导的AmpC酶等。研究表明, E.coli 含有ampG 和 ampD 基因, 虽然E.coli 由于缺乏染色体ampR和AmpR的DNA结合区导致其ampC表达无诱导性, 但是当可诱导性质粒(含有 ampR 和ampC)转移入E.coli 后, 在诱导剂作用下, E.coli 产AmpC酶表型出了诱导性。此外, 当E.coli 的ampD基因突变后, 即使无诱导剂作用, AmpC也会表现出持续高产[9]。
可诱导性质粒ampC表达的主要调节基因, 他们实现功能依赖于彼此的存在。比如AmpD并非通过与ampC结构基因上游结合而起控制作用, 而是通过细胞壁代谢循环产物来调节AmpR的活性状态, 也就是说只有在AmpR和AmpG同时存在的情况下, ampD突变株才能表现出AmpC酶的高表达。因此有报道, AmpD和AmpG共同影响AmpR的活性[14]。
另外实验表明, AmpE与AmpD同时存在时, 比AmpD单独作用, 能更好的阻抑AmpC的表达。但是AmpE本身不能阻抑AmpC的表达, 实验观察到, 仅AmpE失活并不能使ampC去阻遏高表达[12]。
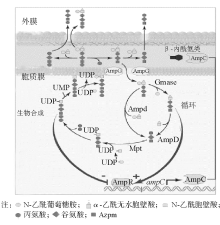
见图2。
1. 细胞壁肽聚糖合成 肽聚糖层网状构架的建立与PBPs密不可分。不同种类的PBPs有不同的生理功能。转糖基作用使anhMurNac与GlcNac以β -1, 4糖苷键相连, 同时anhMurNac上连接的五肽末端的丙氨酸会被羧肽酶水解掉, 游离出4位的丙氨酸。在转肽酶作用下, 该4位丙氨酸与邻近的五肽甘氨酸桥连接。经过PBPs的作用, 肽聚糖最终形成网状空间结构。
2. 抗菌素与PBPs 抗菌素诱导AmpC的表达, 主要通过干扰细胞壁肽聚糖层代谢来实现。几乎所有的β -内酰胺类药物都作用于至少1个以上的PBPs, 导致代谢产物中的三肽和四肽蓄积于周质。强诱导剂如头胞西丁和亚胺培南还可以灭活PBPs 4, PBPs 5, PBPs 6, 阻止五肽侧链末端D-丙氨酸的水解, 影响交联桥的稳定性。这种灭活导致aD-三肽, aD-四肽和aD-五肽在周质聚集, 后通过AmpG转入胞质内, N-乙酰葡萄糖胺和四肽侧链末端氨基酸被去除, 产生大量的aM-三肽和aM-五肽。aM-三肽于AmpR结合激活ampC基因表达[14]。但也有观察发现亚胺培南的诱导调节分子是aM-五肽[11]。N.D.Hanson[2]认为对这种观测结果的解释要慎重。究竟β 内酰胺类抗菌素的诱导能力与其PBPs结合有什么关系, 仍然值得进一步研究。
3. 信号转导通路 肽聚糖分解产物中的N-乙酰无水胞壁酸与多肽(包括三肽, 四肽, 五肽)之间的键由AmpD 裂解, 生成N-乙酰无水胞壁酸或者N-乙酰葡萄糖胺和多肽[11]。其中三肽会形成细胞壁前体UDP-N-乙酰胞壁酸一五肽, 再次参与肽聚糖代谢循环。无诱导剂时, UDP-MurNAc pentapeptide与AmpR结合, AmpR起阻遏作用, AmpC呈组成性低水平表达。当诱导剂作用时, anhMurNac-tripeptide大量产生, 超过了AmpD的水解能力, 于是其在胞质内堆积, 与UDP-MurNAc pentapeptide竞争结合AmpR。当anhMurNac-tripeptide与AmpR结合后, 会使AmpR激活ampC表达。 如果AmpR或AmpD活性位点发生突变使其生理功能障碍, AmpC则去阻遏持续高表达。但是AmpC的去阻遏高表达并不一定是由AmpR或AmpD突变造成[13]。
1. 耐药性产生及传播 某些常见的致病菌如K. pneumoniae(无ampC结构基因)或E.coli(无ampR结构基因及AmpR结合区), 如果他们获得了可诱导性质粒ampC, 那么染色体的不可诱导性ampC就会被质粒的诱导性ampC所补偿, 也就是说受体菌本身的诱导因素可以诱导外来质粒ampC的表达。同样, 当这些菌种的调节基因发生突变后, 也会影响质粒ampC的表达, 比如K. pneumoniae的ampD结构基因突变会导致ampC表达的增加[16]。不可诱导ampC菌株通过获得外源性含可诱导ampC的质粒而获得诱导性, 使该种菌的耐药谱扩大, 并且调控基因突变会使其耐药性更强。
2. 临床治疗 2004年, 韩国学者对部分肺炎克雷伯菌导致的菌血症病例进行回顾性研究发现, 其中产可诱导性质粒AmpC酶的病例(DHA), 在用三代头孢类抗生素(某些病例合用其他药物)治疗后, 死亡率明显高于含有不可诱导质粒AmpC酶的病例(CMY)[17]。但是来自我国台湾的观察发现AmpC酶有无诱导性与治疗失败与否并不明显相关[18]。针对临床回顾性研究的局限性, Black等[18]认为还需要更深入的研究来证明2004年韩国学者的结果。早在90年代初Chow等[19]就对三代头孢的选择突变株作用进行前瞻性观察研究, 发现应用此类药物治疗失败率明显高于其他类抗菌素。2001年, Kaye等[20]通过更大规模调查, 得出了与Chow一致的结论。据此, Livermore等[21]提出对于可诱导性AmpC致病菌, 应该慎用头孢三代药物。但也有学者提出不同见解[22]。所以, 我们需要进一步的体内实验和更多的临床研究来阐明可诱导性质粒AmpC酶临床意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|