作者简介:陈贤冲,男,1965年生,学士,主管技师,主要从事临床检验工作。
通讯作者:陶国华,联系电话:0513-85845167。
探讨外周血胸苷酸合成酶(TS)mRNA和二氢嘧啶脱氢酶(DPD)mRNA检测的临床价值。
方法用逆转录聚合酶链反应(RT-PCR)检测47例肿瘤患者和32例对照患者TS mRNA和DPD mRNA的表达,并作统计学分析。
结果肿瘤组TS mRNA和DPD mRNA的表达率分别为27.7%和23.4%,对照组为9.38%和0.00%,肿瘤组高于对照组( P<0.05)。TS mRNA和DPD mRNA的表达水平与肿瘤的大小、有无淋巴结转移、组织学分级和临床分期均无相关性。
结论用RT-PCR检测外周血TS mRNA和DPD mRNA,操作简便,可反复采样检测,便于临床追踪。
胸苷酸合成酶(thymidylate synthase, TS)和二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase, DPD)是在肿瘤化疗药物5-氟尿嘧啶(5-fluorouracil, 5-FU)代谢通路中起重要作用的酶。由于5-FU疗效确切, 目前仍是胃肠道恶性肿瘤的首选化疗药, 但有些病例对5-FU为主的化疗并不敏感, 从而导致化疗失败。为提高对5-FU原发性和继发性耐药患者的治疗效果, 有必要从分子水平上阐明5-FU耐药机制, 找出能用于评价5-FU化疗敏感性的指标。有研究发现, TS和DPD的表达水平与肿瘤局部的药物浓度密切相关, 并可能影响肿瘤的化疗敏感性[1, 2]。以往研究多为检测肿瘤组织中的TS mRNA和DPD mRNA, 本研究对外周血中TS mRNA和DPD mRNA的检测作了探讨。
实验标本取自南通市第一人民医院的住院患者, 对照组为肝、肾功能正常, 影像检查未见异常的门诊患者。47例消化道肿瘤患者均来源于外科住院手术治疗患者, 并经病理学确诊。其中男28例, 平均年龄62.1岁; 女19例, 平均年龄60.4岁。另选17例消化道良性疾病患者, 平均年龄56.2岁及15名健康人, 平均年龄54.8岁作为对照组。
荧光定量聚合酶链反应(PCR)仪(美国MJ Research公司); 冷冻离心机(德国Hettich公司); CHB-100恒温金属浴(杭州博日公司); DYY-III电泳仪(北京六一仪器厂); VDS700型凝胶影像分析系统(中国计量科学研究院能源所产); Trizol(Invitrogen公司); 逆转录(RT)试剂盒(Qiagen公司); PCR扩增试剂盒(上海生工生物工程技术有限公司)。
1. 细胞总RNA的提取 在无菌冷条件下, 将抗凝血用Ficoll-Hypaque法分离有核细胞, 用焦磷酸二乙酯(DEPC)处理过的磷酸盐缓冲液(PBS)洗涤2次, 用Invitrogen公司的Trizol提取mRNA, 具体操作按照说明书进行。
2. cDNA合成 用Qiagen公司RT试剂盒的随机引物进行RT。
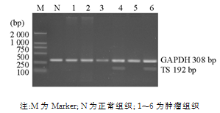
3. RT-PCR 引物由primer premier 5.0软件系统设计, TS引物序列:5'-CTTCAGCGAGAACCCAGACC-3', 5'-TCCAGCCCAACCCCTAAAGAC-3', PCR产物长度192 bp; DPD引物序列:5'-AAACCAGTTCCACGTATAGC-3', 5'-AAACCAGTTCCACGTATAGC-3', PCR产物长度501 bp; 3-磷酸甘油醛脱氢酶(GAPDH)引物序列:5'-TCCCATCACCATCTTCCAG-3', 5'-TGAGTCCTTCCAC-GATACC-3', PCR产物长度308 bp, 由上海生工生物工程技术有限公司合成。反应条件:94 ℃预变性3 min, 再以45循环94 ℃ 40 s; 55 ℃ 45 s; 72 ℃ 40 s; 72 ℃延伸7 min。
4. PCR产物分析 用1.5%的琼脂糖凝胶[含溴化乙啶(EB) 0.5 μ g/mL], 厚度约4 mm, 上样扩增产物5 μ L, 电压为80 V/cm, 电泳30 min, 在SZD700凝胶成像系统下摄像分析。
使用SPSS 11.5统计软件对资料进行分析, 组间数据相关性分析采用χ 2检验。
TS mRNA和DPD mRNA在外周血中的表达水平见表1及图1。肿瘤组TS mRNA和DPD mRNA的阳性表达率为27.7%和23.4%, 对照组为9.38%和0.00%, 肿瘤组高于对照组(P< 0.05)。TS mRNA的阳性表达率高于DPD mRNA, 差异无统计学意义。
| 表1 TS mRNA和DPD mRNA在外周血中表达率的比较 |
TS mRNA和DPD mRNA在外周血中的表达水平与肿瘤的大小、有无淋巴结转移、组织学分级和临床分期均无相关性, 见表2。
| 表2 临床病理特征与TS mRNA和DPD mRNA在外周血中表达水平的关系 |
氟尿嘧啶代谢相关酶类包括TS、DPD和乳清酸磷酸核糖基转移酶(OPRT)。TS在胸腺嘧啶环苷一磷酸的从头合成中起关键作用, 也是DNA合成所必需的。TS主要在分裂和代谢活跃的细胞中保持活性状态。TS是5-FU的中心靶酶, TS的失活引起细胞合成障碍、DNA链的断裂和细胞的死亡。一些研究已经证实TS高表达会导致5-FU耐药[3, 4]。DPD是5-FU分解代谢的第1个酶和限速酶, 这方面已有很多证据支持[5]。在我们研究的47例消化道肿瘤组织中TS mRNA表达水平与对照组差异有统计学意义。肿瘤组明显高于对照组, 这可能是有些患者化疗效果差的原因。许多研究报道, 较高的TS水平对化疗耐受, 而且预后较差[6, 7]。然而也有不同的意见, 认为TS mRNA表达水平和化疗敏感性无关[8]。许多报道指出DPD表达与蛋白活性有相关性, 如Uetake等[9]在研究中发现了DPD活性和DPD mRNA表达的相关性, 这样通过RT-PCR检测DPD mRNA就能反应DPD活性, 预测5-FU的敏感性。本研究发现DPD在肿瘤组和非肿瘤组中的表达是有差异的(P< 0.05), 和TS mRNA一样, 肿瘤组明显高于对照组, 通过检测DPD mRNA亦能反应DPD活性的差异。另外还发现TS mRNA和DPD mRNA在外周血中的表达水平与肿瘤的大小、有无淋巴结转移、组织学分级和临床分期均无相关性, 是一个相对独立的指标。
由于肿瘤患者的生存期在一定程度上取决于肿瘤组织对化疗的反应性以及酶本身所具有的生物学作用, 因此多数学者认为TS和DPD可作为肿瘤的预后因子, 但其影响不同肿瘤预后的强度可能不同。考虑到TS在DNA合成中的作用, 过度表达TS的肿瘤细胞群应具有生长优势潜能, 高TS表达与不良预后有关, 可能是肿瘤细胞增生状态的反映[10]。也有学者认为, TS是通过调节p53表达而影响细胞周期的[11]。DPD对5-FU有降解作用, 在FU尚未形成具有细胞毒性的核苷酸时, 高表达DPD的肿瘤细胞即可将其分解为无活性产物。
本研究结果显示, 采用RT-PCR检测TS和DPD 2种酶在肿瘤患者外周血中的表达是切实可行的。因其不受取材的限制, 可多次重复进行, 有良好的临床应用前景。由于RT-PCR只能反应基因转录水平上的变化, 而不能直接反应蛋白的量和活性, 因此本研究的应用也存在一定的局限性, 值得进一步探讨。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|