通讯作者:高锋,联系电话:021-64369181-58702。
作者简介:张国良,男,1987年生,学士,主要从事肿瘤免疫学研究。
建立肿瘤相关巨噬细胞(TAM)的体外分化模型。
方法分离健康人外周血单核细胞进行体外培养;经白细胞介素4(IL-4)、白细胞介素13(IL-13)刺激后,利用流式细胞术检测细胞表面标志物CD14、CD204、CD206的表达改变;利用酶联免疫吸附试验(ELISA)检测单核细胞白细胞介素10(IL-10)分泌量的改变;继而将刺激后的单核细胞与肿瘤细胞共培养,采用Hoechst染色观察其对肿瘤细胞的杀伤情况。
结果经IL-4和IL-13刺激后,单核细胞表面CD14的表达率未发生明显变化,而CD204和CD206的表达显著增高,同时IL-10的分泌量也显著增高;与肿瘤细胞共培养结果显示,经IL-4/IL-13刺激的单核细胞对肿瘤细胞的杀伤能力显著下降。
结论IL-4/IL-13可在体外诱导单核细胞呈现TAM的表型和功能,适用于TAM分化模型的建立,该模型可应用于针对TAM的相关研究。
To establish the differentiation model of tumor-associated macrophages (TAM) in vitro.
MethodsMonocytes were isolated from the peripheral blood of healthy subjects and cultured in vitro. After stimulation by interleukin 4(IL-4) and interleukin 13(IL-13), the expression changes of molecule markers on monocytes were determined by flow cytometry, including CD14, CD204 and CD206. The levels of interleukin 10 (IL-10) secreted by monocytes were determined by enzyme-linked iummunosorbent assay (ELISA). After coculturing with monocytes, the apoptosis of tumor cells was investigated by Hoechst staining.
ResultsAfter stimulation by IL-4 and IL-13, monocytes exhibited a markedly altered phenotype with retained CD14, the increasing expressions of CD204 and CD206 and the increasing amount of secreted IL-10. Moreover, when coculturing with tumor cells, the cytotoxity of monocytes on tumor cells was inhibited by IL-4/IL-13.
ConclusionsIL-4/IL-13 could induce monocytes to exhibit TAM phenotype and function, indicating IL-4/IL-13 could be applied to the establishment of TAM differentiation model, which can be used in the research of TAM.
恶性肿瘤发生时,外周血单核细胞浸润至肿瘤间质,逐步被诱导分化为肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)。近年研究发现TAM不具有杀伤肿瘤细胞的功能,反而能促进肿瘤生长和发展,其表型特征和功能与M2型巨噬细胞极为相似,是一种“促进肿瘤进展的 M2 型巨噬细胞”[ 1]。TAM是肿瘤间质中的主要免疫细胞,临床研究表明TAM数量与肿瘤患者的预后呈负相关[ 2],利用基因或治疗性方法清除肿瘤局部的TAM将会抑制肿瘤进展[ 3, 4]。然而,目前缺少一种理想的TAM细胞模型来进行相关机制的研究。
在研究TAM与肿瘤细胞相互作用机制的体外试验中,目前应用最多的是利用佛波酯(phorbol myristate acetate, PMA)、白细胞介素4(interleukin 4,IL-4)和白细胞介素13(interleukin 13,IL-13)诱导的THP-1细胞作为TAM模型。在本研究中,我们利用IL-4和IL-13刺激新鲜分离的人外周血单核细胞,通过检测单核细胞表面的分子标志(CD14、CD204和CD206)、分泌的细胞因子及其杀伤功能的变化来确定其是否分化为TAM,以探索能模拟肿瘤微环境中TAM的细胞模型,便于展开相关研究。
人乳腺癌细胞株BT-549(中国科学院典型培养物保藏中心);RPMI1640培养液、胎牛血清(Gibco, 美国);别藻蓝蛋白(allophycocyanin,APC)-抗CD14抗体及同型对照抗体、白细胞介素10(interleukin 10,IL-10) 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(eBioscience,美国),藻红蛋白(phycoerythrin,PE)-抗CD204抗体及同型对照抗体(R&D, 美国),PE-抗CD206抗体及同型对照抗体(Biolegend, 美国);Hoechst 33342 (碧云天,中国);流式细胞仪(Beckman Coulter, CA, 美国);倒置荧光显微镜(Olympus IX70, 日本)。
1. 分离人外周血单核细胞 取正常人体检抗凝血,加入等体积磷酸盐缓冲液(phosphate buffer saline, PBS)充分混匀,将稀释的全血按2∶1比例缓慢沿试管壁铺在淋巴细胞分离液上,室温下1 500× g离心20 min,小心吸出中间的云雾层细胞至另一离心管中,用RPMI1640培养液500× g离心10 min洗涤2次。将洗涤后的细胞重悬于含10%胎牛血清以及100 U/mL青、链霉素的 RPMI1640培养液中,调整细胞浓度为5×106 /mL,台盼兰拒染试验示活细胞>95%。将细胞按以上浓度接种于培养瓶中,置37 ℃、5%CO2培养箱培养2~4 h后吸出培养基,用37 ℃预热的培养液清洗3次,将未贴壁细胞洗脱。
2. 单核细胞诱导分化 上述贴壁细胞经乙二胺四乙酸(ethylenediaminetetraacetic acid, EDTA)消化后离心,弃上清后重悬,接种5×105个单核细胞于T25 培养瓶中,对照组为正常培养,实验组加入IL-4和IL-13刺激。IL-4和IL-13浓度均为20 μg/mL[ 5]。确定IL-4和IL-13刺激时间的预实验如下:用上述浓度的IL-4和IL-13分别刺激单核细胞,分别在3、4、5和6 d时用流式细胞术(flow cytometry,FCM)检测其表面分子标志物的表达。结果显示,单核细胞表面CD204和CD206的表达在IL-4和IL-13刺激5 d后明显增加。因此,在正式实验中我们用20 ng/mL的IL-4和IL-13刺激单核细胞5 d,诱导其分化。
3. FCM检测单核细胞表面特异性抗原 实验分为常规培养组和IL-4/IL-13诱导组。单核细胞经EDTA消化后离心,弃上清后用PBS洗涤2次,计数,2组细胞均按每管约106个细胞的数量,分别收集至2个EP管中,其中实验管加入适量鼠抗人CD14单克隆抗体,对照管加入等体积CD14同型对照抗体,室温避光温育30 min,PBS洗涤2次,500 μL PBS重悬,移至流式测试管中,上机检测。应用同样方法检测单核细胞表面CD204和CD206的表达。
4. ELISA检测单核细胞分泌的IL-10 将分离的单核细胞接种于24孔板(2×105/孔),对照孔为正常培养孔,实验孔加入IL-4和IL-13(均为20 ng/mL),培养5 d后收集上清,离心去沉渣后冻存于-20 ℃冰箱。按上述方法收集3次单核细胞上清,每次均为3复孔,然后按照ELISA试剂盒说明书提供的步骤检测上清中的IL-10含量。
5. BT-549细胞转染红色荧光蛋白(red fluorescent protein, RFP) 将处于对数生长期的BT-549细胞接种于6孔板(2×105/孔),待24 h细胞生长至40%~50%融合时准备转染,弃去上清,于6孔板的每孔中加入含低浓度胎牛血清(<10%)的RPMI1640培养基1 mL,按感染复数(multiplicity,MOI)5、10、15、20加入不同滴度的慢病毒颗粒(Lentivirus-RFP),同时加入聚凝胺(终浓度5 μg/mL),充分摇匀后置37 ℃、5%CO2细胞培养箱中。作用8~12 h后用PBS洗涤细胞,加入10%胎牛血清的RPMI1640培养基继续培养,24、48和72 h后在荧光显微镜下观察转染细胞的红色荧光和细胞毒性反应,以此确定大致转染效率(最佳点时拍照)。利用嘌呤霉素筛选阳性细胞,每隔2~3天加1次抗菌药物,连续筛选2~3次,之后继续培养、传代扩增,建立稳定的细胞株。
6. Hoechst染色检测肿瘤细胞凋亡 将分离的单核细胞接种于24孔板(5×104/孔),对照孔为正常培养孔,实验孔加入IL-4和IL-13(均为20 ng/mL),培养5 d后弃上清,EDTA消化后离心,弃上清后用RPMI1640培养液重悬,将其分别加入事先接种RFP-BT-549细胞的(2×104/孔,培养24 h) 24孔板中。2种细胞共培养24 h后,PBS洗涤2次,4%多聚甲醛室温固定10 min,PBS洗涤后加入适量Hoechst 33342染液,4 ℃避光温育过夜。观察之前PBS洗涤3次,荧光显微镜下细胞核浓缩、染色致密者即为处于凋亡状态的肿瘤细胞,计数。
每组数据均来自3次独立的实验,结果用 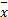
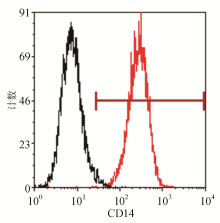
分离人外周血单核细胞后,利用FCM检测单核细胞表面特异标志物CD14的表达率,以确定其纯度。结果显示所分离单核细胞的CD14表达率为97.56%±1.85%。见图1。
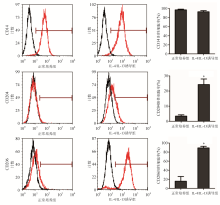
正常培养组单核细胞表面CD204和CD206的表达率均较低,IL-4/IL-13(20 ng/mL)诱导组单核细胞表面CD204和CD206的表达率均显著增高( P<0.001),CD14的表达率无明显差异。见图2。
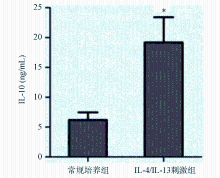
常规培养组单核细胞的IL-10分泌量较低[(6.19±3.12) ng/mL],IL-4/IL-13(20 ng/mL)刺激组单核细胞的IL-10分泌量显著增加[(18.63±10.20)ng/mL, P<0.05]。见图3。
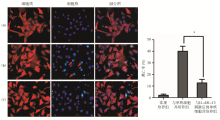
常规培养的RFP-BT-549细胞未观察到凋亡现象;RFP-BT-549细胞与正常单核细胞共培养后,出现大量的凋亡细胞;当RFP-BT-549细胞与IL-4/IL-13诱导后的单核细胞共培养时,RFP-BT-549细胞的凋亡率显著降低( P<0.001)。见图4。
TAM在肿瘤的发生和发展过程中发挥重要作用,可表现在多个环节,其中包括分泌多种生长因子,促进肿瘤细胞的生长[ 6, 7];分泌多种蛋白酶,破坏肿瘤细胞周围的基底膜,从而间接促进肿瘤细胞向周围组织侵袭[ 8, 9];分泌大量促进血管生成的细胞因子和调节血管生成的酶类,并可表达血管内皮生长因子(vascular endothelial growth factor,VEGF)-C 和 VEGF-D,从而促进肿瘤血管和淋巴管的生成[ 10, 11, 12];与肿瘤化疗耐药性密切相关[ 13, 14]。TAM已成为抗肿瘤治疗的作用靶点,而TAM与肿瘤细胞相互作用机制也成为近年研究的热点,但目前缺乏一种理想的TAM细胞模型。现有研究手段主要利用商品化的人外周血单核白血病细胞株THP-1作为巨噬细胞分化的模型,在PMA及IL-4/IL-13的作用下可分化为具有M2表型的巨噬细胞,以作为TAM模型。在体外实验中,将该TAM模型与肿瘤细胞共培养,研究其相互作用及机制[ 15, 16]。然而,THP-1细胞是一种幼稚的单核白血病细胞,处于低分化状态,并不具备人外周血单核细胞所具有的各项免疫学功能。虽然THP-1细胞在PMA及IL-4/IL-13的诱导下可呈现M2型巨噬细胞的表型,但在功能方面并不能模拟单核细胞来源的TAM,因此用其作为TAM模型并不能真正模拟肿瘤微环境中的TAM。
在本研究中,我们分离健康人外周血单核细胞,并利用FCM检测分离纯度。利用IL-4/IL-13刺激纯化的单核细胞后,发现其表面标志物CD204、CD206表达明显增高,IL-10的分泌量也显著升高。CD204是巨噬细胞清道夫受体1(macrophage scavenger receptor 1, MSR1),CD206是巨噬细胞甘露糖受体(macrophage mannose receptor,MMR);IL-10是一种抑制炎性反应的细胞因子,可下调巨噬细胞表面主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ以及协同刺激分子CD80和CD86的表达,使其抗原呈递能力降低,并可抑制巨噬细胞分泌炎性细胞因子和化学因子,使其促炎症能力降低[ 17]。通过经典途径激活的巨噬细胞(M1型巨噬细胞)低表达CD204和CD206,其IL-10的分泌量也较低。而在肿瘤微环境中各种因素的作用下,TAM高表达CD204和CD206,并分泌较多的IL-10[ 18, 19]。本研究中,经IL-4/IL-13诱导的单核细胞高表达CD204和CD206,其IL-10分泌量也显著增高,呈现出TAM的表型。
与表型改变相比,TAM的功能改变同样重要。TAM呈现M2型巨噬细胞的功能,失去了对肿瘤的杀伤能力。本研究结果显示,与对照细胞相比,IL-4/IL-13诱导的单核细胞对肿瘤细胞的杀伤能力显著降低,从而证实其具有TAM的功能。据报道,人外周血单核细胞经巨噬细胞集落刺激因子诱导5~7 d后再经IL-4/IL-13诱导3 d可作为TAM模型[ 5]。本研究利用IL-4/IL-13诱导人外周血单核细胞5 d后也可使其呈现TAM的表型和功能,与现有方法相比,缩减了步骤和时间,可操作性更强,但还需进一步的实验验证该TAM模型的稳定性和实用性,以便未来广泛的应用。
综上所述,本研究已成功建立了TAM体外分化的细胞模型,与利用THP-1细胞建立的TAM模型相比,本研究利用人外周血单核细胞建立的TAM模型在表型及功能方面更能模拟肿瘤微环境中的TAM,可用于研究TAM与肿瘤细胞之间的相互作用及其机制。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|