研究临床耐氟康唑白念珠菌14-α脱甲基酶的K143Q氨基酸置换与氟康唑耐药形成的关系。
方法运用体外定点突变技术构建
真菌体外药物敏感性表型检测显示,含氨基酸置换的表达质粒转染于酿酒酵母INVSc1后,氟康唑最低抑菌浓度(MIC)增加16倍。
结论K143Q可增强白念珠菌对氟康唑的耐药性。
To verify the correlation of K143Q amino acid substitution in 14α-demethylase and fluconzole resistance to
The recombinant mutant plasmid with A427C in
The antifungal drug susceptibility test in vitro showed that the constructed plasmid with amino acid substitution transferred in
The K143Q contributes to increase the resistance to fluconazole in
白念珠菌( Candida albicans)是目前临床最常见的条件致病性真菌,常引起免疫力低下患者的感染,如鹅口疮、念珠菌性阴道炎,甚至是念珠菌血症等疾病。氟康唑因其广谱、高效及良好的生物利用度和安全性等优点,成为临床治疗最广泛的抗真菌药物。美国感染病学会(Infectious Diseases Society of America,IDSA)颁布的2004版真菌病治疗指南中推荐其为各种真菌感染的首选药物。但由于氟康唑对真菌仅具有抑菌作用,因此在预防、经验用药或不规则治疗的频繁给药过程中易产生耐药性。白念珠菌对氟康唑的耐药率由20世纪90年代初期的1%以下上升至目前的5%[ 1]。
细胞色素P-450羊毛固醇14-α脱甲基酶是白念珠菌细胞壁麦角固醇合成途径中的关键酶,也是氟康唑作用的靶酶。该靶酶的编码基因 ERG11容易突变,引起氨基酸置换,导致氟康唑与其的亲和性下降,使白念珠菌对氟康唑产生耐药性[ 2]。研究突变与耐药的关系已经成为解决耐药的关键问题。
我们利用体外定点突变技术、酿酒酵母的异源性表达以及对药物敏感性表型的检测,探讨前期研究中发现的与耐药产生相关的错义突变K143Q与氟康唑耐药性的关系。
1.实验菌株与试剂
1株白念珠菌(ATCC 90028)敏感质控株(由华山医院真菌室赠送);25 μg氟康唑药片(ROSCO);UNlQ-10柱式质粒小量抽提试剂盒及UNIQ-10柱式DNA胶回收试剂盒(大连宝生物工程有限公司);pMD18-T质粒(TaKaRa公司);MutanBEST Kit定点突变试剂盒(TaKaRa公司);pYES2/CT质粒、酿酒酵母(Saccharomyces cerevisiae)INVSc1(Invitrogen公司);高效酵母转化试剂盒(FunGenome公司);聚合酶链反应(polymerase chain reaction,PCR)引物由大连宝生物工程有限公司合成;双向测序由北京六合华大基因科技股份有限公司上海分公司完成。
2.主要仪器
TC-96/T/H(A) 型PCR扩增仪(BIOER公司);Centrifuge 5417R低温高速离心机(Eppendorf公司);紫外凝胶成像系统、水平电泳仪(上海天能科技公司);SCS-24型温控摇床(上海市离心机械研究所);电热恒温水槽(上海医疗机械七厂)。
1.构建野生型(ATCC 90028 ERG11)-pMD18-T重组质粒
白念珠菌(ATCC 90028)DNA的提取:挑取单个菌落,溶解于100 μL裂解液中,置沸水浴3040 min。12 000× g离心5 min,收集上清液。 ERG11基因的扩增:根据GenBank数据库内基因文库登录号A006854.1为已知序列设定1对引物,P1为 5'-ATGGCTATTGTTGAAACTGTCATT-3' ,P2为 5' -AAACATACAAGTTTCTCTTTTTTC-3'。PCR反应体系(25 μL):TaqDNA聚合酶(1 U/μL)1 μL,10×PCR Buffer 2.5 μL,dNTP Mixture(25 mmol/L)0.2 μL,DNA模板(200 ng)4 μL,上、下游引物(50 μmol/L)各0.2 μL,再加入蒸馏水和石蜡油。PCR反应条件:94 ℃ 预变性5 min;94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸90 s,35个循环;72 ℃再延伸5 min。PCR产物用1%凝胶电泳,溴化乙锭(ethidium bromide,EB)染色,紫外灯下观察,凝胶图像分析仪记录并切下目的片段。利用UNIQ-10柱式DNA胶回收试剂盒纯化回收目的条带。PCR回收目的条带4.5 μL,pMD18-T质粒0.5 μL,Ligation Solution I 5 μL,16 ℃过夜连接。连接产物再利用CaCl2法转化入大肠埃希菌感受态DH5α,并涂布于氨苄LB平板(含1%NaCl、1%蛋白胨、0.5%酵母浸液、2%琼脂粉、100 g/L氨苄西林),37 ℃孵育过夜。挑取克隆菌落,于氨苄LB培养基37 ℃ 摇床过夜;利用UNlQ-10柱式质粒小量抽提试剂盒抽提质粒,并送测序,使用序列同源性分析软件Blast比对A006854.1序列,证实重组质粒,并以30%甘油溶液于-20 ℃ 条件下保存。
2.构建定点突变-pMD18-T重组质粒
PCR反应体系(50 μL):Pyrobest DNA Polymerase(5 U/μL) 0.25 μL,10×Pyrobest Buffer 5 μL,dNTP Mixture(各2.5 mmol/L)4 μL,上、下游引物(20 μmol/L)各1 μL,野生型-pMD18-T重组质粒模板4 μL,H2O 34.75 μL。PCR反应条件同上。目的片段凝胶电泳,切胶纯化回收。配置混合液如下:含10×Blunting Kination Buffer 2 μL,Blunting Kination Enzyme Mix 1 μL,H2O 9 μL,PCR回收目的片段 8 μL,37 ℃水浴10 min,70 ℃水浴10 min。取末端平黏产物和Ligation SolutionⅠ各5 μL,均匀混合于微量离心管中,16 ℃ 过夜连接。利用CaCl2法转化入DH5α,利用氨苄筛选克隆。重组质粒抽提和测序分析同上,证实重组质粒后以30%甘油溶液于-20 ℃ 条件下保存。定点突变K143Q引物序列:上游引物 5' -TTAATGGAACAACAAAAATTTGCT-3' ,下游引物5' -TCTAGAATTTGGACAATCATAAAT-3' 。
3.构建野生型和突变型-pYES2/CT重组质粒
以野生型、突变型- pMD18-T重组质粒作为模板进行PCR扩增,反应体系和反应条件同“1.构建野生型(ATCC 90028 ERG11)-pMD18-T重组质粒”。引物序列: 5'-ATATGGTACCATGGCTATTGTT-GAAACTGTC-3' (P1),5' -CGCCTCGAGGAAACA-TACAAGTTTCTCTTTT-3' (P2)。目的片段凝胶电泳,切胶纯化回收。酶切反应体系20 μL,包括10×L Buffer 2 μL,KpnⅠ限制性内切酶 1 μL,XhoⅠ限制性内切酶 2 μL,载体及PCR扩增产物各15 μL,于37 ℃ 水浴酶切过夜。酶切产物凝胶电泳,切胶回收。7 μL 野生型和突变型重组质粒PCR酶切产物与1 μL 酶切pYES2/CT载体混合,于65 ℃水浴箱放置2 min,室温冷却后,加入8 μL Ligation SolutionⅠ,16 ℃连接2 h。利用CaCl2法转化入DH5α,利用氨苄筛选克隆。重组质粒抽提和测序分析同上,证实重组质粒后以30%甘油溶液于-20 ℃ 条件下保存。
4. 酿酒酵母INVSc1的异源性表达和药物敏感性表型检测
抽提野生型和突变型-pYES2/CT重组质粒和pYES2/CT空质粒,用分光光度计检测dsDNA浓度。采用高效酵母转化试剂盒将重组质粒及空质粒转染INVSc1,转染液用无菌三角玻棒涂布于缺Ura YNB(含2%葡萄糖)培养基上,于30 ℃孵箱内孵育23 d,筛选克隆,其中质粒DNA浓度约为3 μg。挑选克隆置于缺Ura YNB(含2%半乳糖和1%棉籽糖)培养液,30 ℃孵箱内表达过夜。采用85%生理盐水稀释菌液浓度达到1×103~5 ×103 CFU/mL,取100 μL加入1×缺Ura YNB(含2%半乳糖和1%棉籽糖)培养液配制的96孔无菌药板中,30 ℃孵箱培养4 d。药板配制方法和结果判读按照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)M27-A2方案。
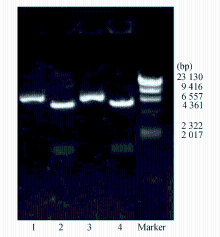
白念珠菌(ATCC 90028) ERG11基因的PCR扩增结果及野生型重组质粒白念珠菌(ATCC 90028) ERG11- pMD18-T质粒见图1。野生型、突变型-pYES2/CT重组质粒的酶切电泳图见图2:
体外诱导pYES2/CT空质粒及野生型和突变型-pYES2/CT重组质粒成功转染酿酒酵母INVSc1,体外氟康唑药物敏感性表型检测结果显示:与野生型重组质粒[最低抑菌浓度(minimum inhibitory concentration, MIC)=16 μg/mL]和空质粒(MIC=16 μg/mL)比较,K143Q突变型重组质粒的氟康唑MIC(MIC=256 μg/mL)明显增加,增加达16倍。
近年来随着广谱抗菌药物、皮质激素和免疫抑制剂的广泛应用,外科介入疗法的逐渐增多以及肿瘤放疗、化疗的影响,临床上白念珠菌的感染率呈明显上升趋势。目前能有效用于治疗念珠母菌感染的药物较少,而作为临床抗真菌治疗应用最广的氟康唑在长期治疗和重复给药的过程中逐渐出现了对白念珠菌敏感性下降。此外大部分抗药性菌株还存在交叉抗药性,成为临床上治疗失败的主要原因。
白念珠菌对氟康唑产生耐药的主要机制有以下几点:(1)膜蛋白ABC转运蛋白超家族(ATP-binding cassette transporters,ABC transporters)编码基因 CDR1、 CDR2和易化扩散载体超家族(major facilitator superfamily, MFS)编码基因 MDR1过度表达,导致菌体细胞内药物浓度降低;(2)麦角固醇生物合成通路中关键靶酶编码基因 ERG11点突变或表达过量;(3)膜甾醇合成通路中△5,6去饱和酶编码基因 ERG3缺失;(4)生物膜形成等[ 3]。
ERG11基因突变频度大,平均每序列1.85个基因突变,但绝大部分为无义突变。迄今为止,已发现产生氨基酸置换的点突变近160余种[ 4, 5, 6]。从一级结构上看,它们不是随意分布,而是主要集中于3个热点区,即氨基酸105165、266287和405488[ 7]。
耐药菌株往往同时存在多个错义突变。Lamb等[ 8]和Sanglard等[ 9]首先利用定点突变技术和异源性表达酿酒酵母证实单一点突变引起氨基酸置换,足以使氟康唑与白念珠菌的亲和力下降,而导致氟康唑耐药的产生。目前仅A61V、S405F、G464S、R467K、I471T氨基酸置换与耐药产生的相关性已由点突变技术证实; ERG11基因PCR扩增的体外功能性表达分析结果表明K143E、K143R、T229A、Y257H、D278N、G307S、D446N、G448V、F449S、G450E位点与氟康唑耐药产生有一定的联系[ 5]。此外,Sanglard等[ 9]还运用定点突变技术研究了多位点组合的作用,发现多位点结合变异能使亲和力下降更明显,Y132H与S405F以及Y132H与R467K点突变组合可能与其高水平耐药有关。而G129A单独并不能导致耐药发生,但其联合G464S可使氟康唑的MIC升高16倍。而广泛存在于敏感株和耐药株的E266D、V488I、K128T和D116E则与耐药性的产生无关。
临床菌株药物敏感性表型和PCR测序的初步研究发现,在23株白念珠菌菌株中共检出16个同义突变位点和17个错义突变位点[ 10]。错义突变中,D116E、K128T、E266D、Y205E、V437I及A255V同时出现于敏感株,与耐药形成无关。而该研究新发现错义突变K143Q、E260V、N435V、G472R、D502E位点及已有报道的A114S[ 11]、Y257H[ 11]、Y132F[ 12]、Y132H[ 8]、K143R[ 12]、G448E[ 13]位点可能与耐药性的产生相关。本研究通过定点突变技术体外构建重组质粒,并于酿酒酵母异源性诱导表达,通过药物敏感性试验研究K143Q错义突变与耐药的关系。结果显示K143Q突变型重组质粒氟康唑的MIC值明显高于未含点突变的野生型重组质粒,药物敏感性下降,证实该位点突变与耐药性的产生相关。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|