作者简介:温冬梅,1976年生,女,副主任技师,主要从事临床生物化学检验和实验室管理工作。
通讯作者:张秀明,联系电话:0760-89880477。
评价免疫抑制比浊法(TINIA)检测糖化血红蛋白(HbA1c)的分析性能,与离子交换高效液相色谱法(IE-HPLC)检测HbA1c进行比对和偏倚评估,并评估血红蛋白(Hb)变异体E(HbE)对TINIA和IE-HPLC的影响。
方法参考美国临床与实验室标准化协会(CLSI)发布的方法学评价系列文件(EP文件)及有关文献,对TINIA检测HbA1c的精密度、正确度、分析测量范围、分析干扰以及生物参考区间进行评价和验证,对TINIA与IE-HPLC检测Hb结构正常的血液样本和含HbE的血液样本进行对比分析和偏倚评估,分析患者平均血糖的相关性。
结果TINIA检测HbA1c 的批内精密度<2.08%,总不精密度<2.94%;在HbA1c浓度为4.4%~18.3%范围内,理论值与实测均值呈线性相关(
TINIA检测HbA1c的分析性能符合临床测定的性能要求,不受HbE的干扰。当HbE>6.4%时,IE-HPLC法检测HbA1c会受干扰,出现假性增高的情况。
To evaluate the analysis performance of glycosylated hemoglobin A1c(HbA1c) detection by turbidimetric inhibition immunoassay (TINIA), to compare and evaluate the bias with ion exchange high performance liquid chromatography (IE-HPLC) for detecting HbA1c, and to evaluate the influence of hemoglobin (Hb) E (HbE) on TINIA and IE-HPLC.
MethodsAccording to the methodology evaluation document (EP document) and relevant literatures from the Clinical and Laboratory Standards Institute (CLSI), the precision, accuracy, detection range, analysis interference and biological reference interval analysis of HbA1c detection by TINIA were evaluated and verified. The comparison analysis and bias evaluation of TINIA and IE-HPLC for blood samples with normal Hb structure and blood samples in HbE patients were performed. The correlation with average blood glucose was analyzed.
ResultsThe within-run precision by TINIA was < 2.08%, the total imprecision was <2.94%, and the theoretical value with detection mean value was linearly correlated in the concentration range of 4.4%-18.3%(
The performance of HbA1c detection by TINIA meets the performance requirements of clinical determination, and has a good correlation with that by IE-HPLC without interference by HbE. When HbE>6.4%, IE-HPLC for the detection of HbA1c has interference, and there will be false increasing.
糖化血红蛋白A1c(glycosylated hemoglobin A1c,HbA1c)是评价糖尿病患者长期血糖控制的金标准。2010年美国糖尿病联合会(American Diabetes Association,ADA)已将HbA1c≥6.5%作为糖尿病的诊断标准之一[ 1],但我国尚未将HbA1c作为糖尿病诊断标准。各地实验室HbA1c检测方法种类繁多,检测结果差异较大和对HbA1c的干扰因素不了解等是目前限制我国使用这一糖尿病诊断新指标的主要原因。所以,对HbA1c检测方法分析性能和干扰因素进行评价以保证检测结果的准确性已显得至关重要。血红蛋白(Hb)变异体、氨甲酰化Hb和血液系统疾病等因素会不同程度地干扰不同检测方法[ 2, 3, 4, 5]。Hb变异体E(HbE)是全球第2位常见的Hb变异体。我国南方地区也是地中海贫血和Hb病的高发区。因此,我们参考美国临床实验室标准化协会(CLSI)发布的方法学评价文件(EP文件)[ 6, 7, 8, 9],全面系统地评价免疫抑制比浊法(turbidimetric inhibition immunoassay, TINIA)检测HbA1c的分析性能,并与离子交换色谱法(ionexchange high performance liquid chromatography,IE-HPLC)进行比对和偏倚评估。
一、材料
1.对象 标本来源于2012年1月至2013年5月在中山大学附属中山医院住院、门诊患者或健康体检者。正常对照组为中山大学附属中山医院康体保健中心体检的健康成人20名,其中男10名,年龄18~59岁,女10名,年龄20~55岁;糖尿病组为在中山大学附属中山医院确诊的2型糖尿病患者30例,除外贫血、Hb变异体、高胆红素、高血脂和尿毒症患者,其中男15例,女15例,根据世界卫生组织(WHO)1999年诊断标准确诊。 HbE组15例,其中男5例,女10例。
2.仪器和试剂 美国Bio-Rad公司VARIANTTM II Turbo 全自动HbA1c分析仪和配套试剂;Trinity ultra2全自动HbA1c分析仪和配套试剂;德国Roche Modular PPI全自动生化分析仪和配套试剂;法国Sebia Capilarys毛细管蛋白电泳分析仪和配套试剂;日本Sysmex干扰试剂盒[批号:JIS K0101;干扰物浓度分别为游离胆红素(FBiL)3 280 μmol/L(192 mg/L)、结合胆红素(CBiL)3 280 μmol/L(192 mg/L)、Hb 49.6 μmol/L(4 960 mg/dl)、乳糜(CH) 15 000 FTU]。
3.标本采集 (1)HbA1c:静脉抽血2 mL,乙二胺四乙酸(EDTA-K2)抗凝,用全血检测;(2)空腹血糖(fasting plasma glucose,FPG):空腹静脉抽血2 mL,氟化钠抗凝,分离血浆检测。
二、方法
1.检测方法 分别采用IE-HPLC(Bio-Rad VARIANTTM II Turbo检测系统)、亲和析高压液相法(Trinity ultra2检测系统)、第3代TINIA(Roche Modular PPI检测系统)检测HbA1c。采用已糖激酶法(hexokinase,HK)检测血浆FPG,采用毛细管电泳法(Sebia Capilarys毛细管电泳分析仪)进行Hb电泳。
2.精密度实验 参考EP15-A2文件[ 5],选取5份不同浓度的标本,其中2份为Bio-Rad HbA1c质控液,3份为低、中、高不同浓度的新鲜全血。所有实验样本每天批内重复测定3次,连续5 d。
3.正确度实验 参考EP15-A2文件[ 6],对卫生部临床检验中心同期发放的5份室间质量评价调查品进行检测,每一分析物分布在5个不同的分析批次测定,每一样品重复测定2次。
4.分析测量范围(AMR)实验 参考EP6-A文件[ 7],收集HbA1c为18.3%的高值全血样本和4.4%的低值全血样本,按1L、0.8L+0.2H、0.6L+0.4H、0.4L+0.6H、0.2L+0.8H、1H等不同稀释浓度形成系列浓度全血,对系列全血在检测系统上检测,重复4次,在1个分析批次内完成。
5.分析干扰实验 参考EP7-A2文件[ 8],选择浓度为10.4%和6.2%的2个全血样品作为基础样本,以添加不同浓度FBiL、CBiL、Hb和CH等干扰物之后的HbA1c测定均值超过同一浓度下的空白对照管的±5%为产生干扰作用。
6.生物参考区间验证 参考C28-A2文件[ 9],对20个参考个体进行HbA1c检测。检测结果用“1/3”规则进行离群值检验。
7.正常对照组和糖尿病组两种检测系统的比对分析和偏倚评估 参照EP9-A2[ 10]文件,以性能分析指标通过验证的IE-HPLC为比较方法, TINIA作为实验方法, 检测HbA1c 含量在4.1%~13.9%、Hb结构正常的40份正常对照组和糖尿病组血液样品,每天检测8份,连续测定5 d。
8.HbE组两种方法的比对分析和偏倚评估及与平均血糖的相关性分析 分别用TINIA和IE-HPLC检测15份HbE浓度在5.4%~54.7%范围内的血液样品的HbA1c浓度,计算估计平均血糖值(estimated average glucose, eAG)[ 11],判断两种方法对HbE组的检测结果是否有差异及与平均血糖水平的相关性。
9.不同浓度HbE样品的制备 以Hb结构正常的全血样品(HbA浓度为96.8%, HbA2浓度为3.2%)为1号样品,以HbE含量为54.7%的全血样品为5号样品,1号和5号样品分别按3∶1、1∶1和1∶3的比例混合,分别作为2~4号样品。采用毛细管电泳法检测5个样品的HbE浓度。用不受HbE干扰的分析性能得到验证的Trinity Primus检测系统检测HbA1c浓度[ 12],通过HbA1c浓度和总的出峰面积计算得出各混合样品的HbA1c理论浓度,再分别用TINIA和IE-HPLC检测含不同浓度HbE的样品,每组检测2次。
三、统计学方法
所有资料应用Excel和SPSS 13.0软件进行统计分析。各组间均数比较采用 t检验。 P<0.05为差异有统计学意义。
一、精密度实验
TINIA测定不同浓度新鲜全血和质控品HbA1c的不精密度性能结果见表1。与厂商声明值(HbA1c浓度为4.1%、9.2%和10.5%时厂商声明的批内 CV分别为2.2%、2.3%和1.8%,总 CV分别为4.4%、3.2%和3.0%)比较,各分析水平的实际 CV均低于厂商声明的 CV,厂家声明的精密度性能得到验证。
| 表1 TINIA法检测HbA1c的精密度性能结果 |
二、正确度实验
对5份定值室间质量评价调查品进行检测,结果见表2。5个不同浓度的样品偏倚的验证区间均包含了靶值,正确度性能得到验证。
| 表2 TINIA检测HbA1c正确度验证结果 |
三、AMR
通过对系列浓度全血样品的HbA1c浓度和总的出峰面积计算得出HbA1c理论浓度,对预期值和实测值进行回归分析,回归方程为 Y=1.04 X-0.089 9, b接近于1, a接近于0, r=0.999 4。在实验所涉及的浓度范围内(4.4%~18.3%)呈线性。
四、分析干扰实验
FBil<328.0 μmol/L、CBil<328.0 μmol/L、Hb<49.6 g/L、CH<12 000 FTU对TINIA检测HbA1c基本无干扰(差异百分比<5%为无干扰),但高浓度CH(15 000 FTU)所产生的干扰超过临床可接受的允许误差,但基本上符合临床的检测要求。见表3。
| 表3 TINIA检测HbA1c 2个不同浓度样品干扰实验结果 |
四、生物参考区间验证
不同年龄的10名男性健康参考个体HbA1c浓度为5.1%~5.7%,不同年龄的10名女性健康参考个体HbA1c浓度为4.8%~5.7%,20名健康参考个体总的HbA1c浓度为4.8%~5.7 %,均落在厂商提供的参考区间内,厂商提供的参考区间(4.8%~5.9%)得到验证,可以直接使用。
五、 正常对照组和糖尿病组TINIA和IE-HPLC HbA1c检测结果的比较与偏倚评估
对正常对照组和糖尿病组80个实验数据作散点图和偏倚图,见图1~4。其中 r2≥0.95,实验样本浓度范围合适。参照NGSP认证对Ⅱ级定值检测实验室比对系统与参比系统检测值百分偏差的绝对值<8%的可接受标准,HbA1c医学决定水平为6.5%时其允许偏倚为(0.26),预期偏倚Bc^的95%可信区间( CI)为[-0.157,-0.098],<允许偏倚0.26;HbA1c的医学决定水平为9.0%时其允许偏倚为0.36,预期偏倚Bc^的95% CI为[-0.151,-0.097],<允许偏倚(0.36),两者具有良好的相关性。方法的测定结果差异无统计学意义( P<0.05)。
六、HbE组TINIA和IE-HPLC检测HbA1c的比较及与平均血糖的相关性分析
由TINIA测定HbA1c结果计算得出的eAG结果和FPG结果的差值为-5~6 mg/dL。对eAG结果和FPG结果进行回归分析,方程为 Y=1 .013 X-0.972, r=0.999, P=0.320,差异无统计学意义( P>0.05),且HbA1c和FPG呈高度相关( r=0.998 8),见图5。TINIA检测HbA1c不受HbE 的干扰。
由IE-HPLC法测定HbA1c结果计算得出的eAG结果和FPG结果的差值为6~128 mg/dL。对eAG结果和FPG结果进行回归分析,方程为 Y=1.051 4X+31.13, r=0.906, P=0.001 3,差异有统计学意义( P<0.01),见图6。IE-HPLC检测HbA1c受HbE干扰,结果偏高。见表4。
| 表4 HbE组TINIA和IE-HPLC HbA1c检测结果的比较及与平均血糖的相关性分析 |
HbE组TINIA和IE-HPLC检测HbA1c结果的差异有统计学意义( P<0.01)。见图7。
七、不同浓度的HbE 对两种方法测定HbA1c 的影响
用毛细管电泳法检测5个样品的HbE浓度分别为0.0%、6.4%、13.4%、21.7%和54.7%。TINIA的检测值与理论浓度平均差值的95% CI为-0.20~0.10,低于理论浓度±0.75%HbA1c的控制标准,且 r值为0.978;平均偏倚为-4.1%~1.9%,均<5%。可见含不同浓度HbE的样品TINIA检测结果与预期值无差异,几乎不受HbE 的干扰。
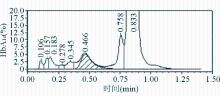
当HbE>6.4%时,IE-HPLC检测含不同浓度HbE的样品的平均偏倚为5.7%~278.7%,均>5%,测定结果均高于预期理论结果,对HbA1c检测存在一定的影响;当血液样品中HbE浓度高达54.7%时,其HbA1c测定结果远远高于预期理论结果,平均偏倚高达278.7%,测定结果与预期理论结果有明显差异。见表5。Hb结构正常的全血样品的IE-HPLC检测HbA1c的图谱见图8;HbE浓度为54.7%时IE-HPLC检测HbA1c的图谱见图9。
| 表5 不同浓度的HbE 对两种方法测定HbA1c的影响 (%) |
近年来,HbA1c在糖尿病的筛查、诊断和治疗中发挥着极为重要的作用,其检测方法有离子交换法、亲和层析法和免疫分析法等多种方法,每种方法各有优势。不同的检测方法受不同影响因素的干扰,从而影响糖尿病的诊断。Hb变异体会不同程度地干扰不同检测方法。HbE是全球第2位常见的Hb变异体,主要存在于东南亚人群中,由β珠蛋白基因第26位的谷氨酸被赖氨酸取代所产生,是一种β地中海贫血样的Hb病。但因谷氨酸和赖氨酸理化性质相似,对Hb分子的稳定性和功能影响不大,文献报道HbE 杂合子无临床症状[ 12]。本研究主要参考CLSI EP系列文件对TINIA检测HbA1c的分析性能进行评价,并评估HbE对TINIA和IE-HPLC检测HbA1c的干扰程度。旨在了解免疫分析方法检测HbA1c的分析性能及为HbE人群选用合适的HbA1c检测方法,保证HbA1c检测的准确性。
TINIA检测不同浓度HbA1c的批内 CV分别为2.08%、1.97%、1.28%、1.82%和1.57%,总 CV分别为2.94%、2.78%、1.80%、2.56%和2.21%,均<厂商声明的 CV,厂家声明的精密度性能得到验证。对5份定值室间质量评价调查品进行检测,偏倚的验证区间均包含了靶值,正确度性能得到验证。对系列浓度样本进行检测,并对预期值和实测值回归分析,回归方程为 Y=1 .014 4 X-0.089 9, r=0.999 4,AMR为4.4%~18.3%,具有良好的线性。干扰实验结果显示TINIA具有良好的抗溶血、脂血、黄疸和CH的能力。厂商提供的参考区间(4.8%~5.9 %)得到验证,适用于本实验室。
正常对照组和糖尿病组TINIA和IE-HPLC检测HbA1c的结果具有良好的相关性( r=0.999 5),两种方法具有可比性。但HbE组TINIA和IE-HPLC检测HbA1c的结果差异有统计学意义( P<0.01)。另外,本研究结果显示,TINIA测定HbE组HbA1c的结果与FPG结果呈高度相关( r=0.998 8)。不同浓度的HbE 对两种方法测定HbA1c 的影响结果显示,采用TINIA检测含不同浓度HbE的样品,其HbA1c实测值与预期理论浓度的平均偏倚为-4.1%~1.9%,均<5%,TINIA几乎不受HbE 的干扰;而IE-HPLC检测HbA1c随着HbE浓度的增高,实测值与预期理论浓度的平均偏倚逐渐增大,当样品中HbE浓度高达54.7%时,其HbA1c实测结果远远高于预期理论值,平均偏倚高达278.7%。由此可见,IE-HPLC检测HbE患者的HbA1c浓度时会受HbE干扰,出现HbA1c假性增高的情况,与Little等[ 13]的研究结果一致。IE-HPLC检测所有HbE的色谱图均包含“变异体窗口”中的1个色谱峰,该色谱峰显示为1个分裂的A0峰,图谱显示出峰时间(RT)稍微有点滞后,导致真正的A0错认为Variant Window,图中的A0应该为E。由于这个问题,同时E的量低于A0的,导致A1c假性增高。但TINIA的检测结果未受到HbE的干扰。可能是由于免疫学方法抗体特异性的结合Hb β-链 N-末端HbA1c 糖化部分,而HbE的氨基酸替代远离这部分,因此检测结果不受干扰。由此可见,在有HbE干扰的情况下,TINIA的抗干扰能力优于IE-HPLC。
本研究结果显示,TINIA具有良好的分析性能和抗干扰能力,检测结果不受HbE的干扰,适用于临床。IE-HPLC由于操作简便、快速、精密度好,检测结果能溯源到DCCT而成为检测HbA1c的金标准方法,其分析图谱可以识别Hb变异体的存在,但检测结果宜受HbE的干扰而呈假性增高。因此,为保证HbA1c检测结果的准确性,实验室工作人员均应具备分析HbA1c检测图谱的能力,识别是否存在Hb变异体。若出现异常峰或发现检测结果与血糖浓度不相关时,且进一步确定存在HbE,则可选用其他合适的检测方法,确保HbA1c检测质量能够完全满足临床需求;或选用其他替代指标,如糖化血清蛋白、糖化白蛋白或连续监测血糖,客观、准确地对患者的血糖控制情况进行监测。
(收稿日期:2013-11-25)
(本文编辑:范基农)
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|