流感病毒是有包膜的单股负链RNA病毒, 属于正黏病毒科 (orthomyxoviridae),根据核衣壳蛋白和基质蛋白不同, 分为甲 (A) 、乙 (B) 、丙 (C) 3型[ 1]。甲型H1N1流感于2009 年3月在墨西哥爆发, 最初被称为“人感染猪流感”, 世界卫生组织将流感大流行警告级别提高为6级[ 2],2009年4月中国卫生部发布公告, 明确将猪流感更名为“甲型H1N1流感”。 据世界卫生组织统计, 截至2010年3月19日, 这种新病毒已经波及213个国家, 共造成16 813例死亡[ 3]。许多学者认为华南地区是世界流感流行的一个主要起源地, 因此加强对甲型H1N1流感的监测对我国传染病防控具有重要意义[ 4]。神经氨酸酶 (neuraminidase, NA) 是流感病毒表面重要的糖蛋白, 是甲型流感病毒主要抗原之一, 对于流感病毒从感染细胞中的释放非常重要。为了监测甲型H1N1流感NA基因的变异情况, 及时发现具有流行病学意义的耐药株, 我们对2010年从广州采集的1 194份呼吸道标本中分离到的6株甲型H1N1病毒株NA基因进行测序, 与2009年的代表株进行比对, 对其耐药位点和同源性进行分析, 了解其变异情况, 为今后流感的监控和防治提供参考资料。
2010年2到12月广州市中山大学附属二院和三院发热门诊病例咽拭子标本1 194份, 病例纳入标准为:发热3 d以内, 体温≥38 ℃;伴有咳嗽或咽喉疼痛等急性上呼吸道感染症状。
2010年本实验室分离的甲型H1N1流感病毒和2009年3月本实验室从广州市第1例甲型H1N1流感病毒感染患者体内分离的毒株, 名称为A/Guangdong/03/2009 (H1N1)(GenBank登录号GQ250161);从 GenBank中选取北京、上海、广东三地在2009年甲型H1N1流感流行时的NA序列共9株, 用以基因分型和比较, 见表1:
| 表1 NA基因用以进化分析的毒株 |
对采集的咽拭子标本进行处理, 各取200 μL提取RNA (QIAmp MiniElute Virus Spin试剂盒),逆转录合成cDNA (Invitrogen, Superscript Ⅲ first strand逆转录试剂盒),操作步骤参照说明书进行, 反应条件为:25 ℃ 10 min, 50 ℃ 50 min, 85 ℃ 5 min, 37 ℃ 20 min。
对1 194份标本的cDNA全部进行甲型流感病毒检测。
1.引物 参照国家流感中心下发的引物, 目标片段为M基因, 上游引物5′-TTCTAACCGAGGTCGAAACG-3′, 下游引物5′- ACAAAGCGTCTACGCTGCAG-3′, 特异产物长度235 bp。
2.聚合酶链反应 (polymerase chain reaction, PCR) 反应体系 TaKaRa ExTaq mix 12.5 μL, 焦碳酸二乙酯水 7.5 μL, 上、下游引物各2 μL;cDNA模板1 μL。 反应条件:95 ℃ 5 min, 94 ℃ 30 s, 52 ℃ 30 s, 72 ℃ 1 min, 35个循环, 72 ℃ 10 min。
对甲型流感病毒检测阳性的标本进行甲型H1N1流感病毒特异PCR检测。
1. 引物 参照国家流感中心下发的引物, 目标片段为HA基因, 上游引物5′-AATAACATTAGAAGCAACTGG-3′, 下游引物5′-AGGCTGGTGTTTATRGCACC-3′, 特异产物长度153 bp。
2.PCR 同上。
参考GenBank中甲型H1N1流感病毒株NA序列 (GenBank 登陆号GQ250162) 分别设计分段引物NA-1和NA-2, NA-1引物扩增1~643 bp, NA-2引物扩增505~1 410 bp,NA基因全长1 410 bp, 引物序列见表2:
| 表2 NA基因扩增引物 |
PCR反应体系:TaKaRa ExTaq mix 25 μL, 焦碳酸二乙酯水 15 μL, 上下游引物各4 μL, cDNA模板2 μL。 反应条件:95 ℃ 5 min, 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 35 个循环, 72 ℃ 10 min。
胶回收试剂盒 (TAKATA) 回收PCR产物, 连接到pMD 18-T Vector (TAKATA),转化DH-5α感受态细胞, 用Amp+LB筛选阳性菌落提取重组质粒, PCR初步鉴定重组质粒, 送上海英骏公司测序。
利用 Clustal 1.83软件[ 5]对测序毒株HA基因序列和氨基酸序列进行比对和分析, 利用Glyc 1.0 Server (http://www.cbs.dtu.dk/services/NetNGlyc/)在线软件预测其糖基化位点, 并对其耐药位点进行分析。
将分离的6株广州甲型H1N1流感病毒分离株和从GenBank中筛选的9株甲型H1N1流感病毒的HA基因用MEGA4.0软件[ 6]近邻连接法 (neighbor-joining method) 构建系统进化树。
1 194份咽试子标本中检测甲型流感病毒327份, 其中检测到H1N1流感病毒6株。
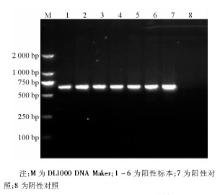
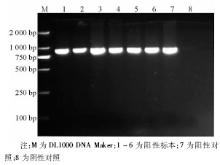
6株甲型H1N1流感病毒分离株NA-1段基因的逆转录PCR产物全长643 bp, 见图3。6株甲型H1N1流感病毒的NA-2 段基因的逆转录PCR产物全长905 bp, 与理论值相符, 见图4。回收PCR扩增产物, 与T载体连接, 由上海英骏公司进行测序 (结果略) 。
1.NA基因同源性分析 2009年流感病毒代表株和2010年流感病毒分离株共15株, 将其NA基因共1 410个碱基, 用Clustalx 1.83进行序列比对, 用BioEdit软件得到15株NA基因的氨基酸相似性矩阵, 见表3。2010年分离株和2009年代表株氨基酸相似性较高, 介于0.985~0.999。
| 表3 NA核酸相似性矩阵 |
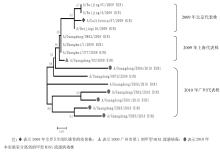
2.NA系统进化树分析 根据NA基因全长序列 (1 410 bp),对2009年代表株和2010年分离株共15株甲型H1N1流感病毒株进行了系统进化分析, 包括本研究分离到的6株, 还有选取的2009年代表株。在系统进化树上, 15株毒株分成了3个分支, 见图5:
3.氨基酸变异分析 2010年分离的6株甲型 H1N1 流感病毒的NA基因与2009年中国大陆的代表株比对, 6株分离株共有30个碱基位点发生突变, 其中有义突变为16个, 3个位点和NA活性相关, 其中222位氨基酸的变异位于NA活性位点上, 未发现H275Y耐药位点的变异, 见表4:
| 表4 2010年分离株和2009年代表株NA片段氨基酸比对结果 |
4.糖基化位点变异分析 分别将2010年广州市分离到的6株甲型H1N1病毒株和2009年代表株NA基因进行糖基化位点的预测。结果发现4株甲型H1N1病毒株的糖基化位点和2009年代表株相比并没有明显的变化。
5.NA蛋白结构建模 通过蛋白分析专家系统EXPASY (http://ca.expasy.org/)提供的蛋白组学和序列分析工具SWISS-MODEL, 模拟构建各NA蛋白的空间构象。3株病毒株在NA活性位点222位、228位和425位等氨基酸位点处发生了变异, 见图6:
NA蛋白是流感病毒包膜上重要的糖蛋白, 能切断细胞表面的唾液酸, 促使病毒从感染细胞膜上释放, 防止子代病毒自身凝集, 促进病毒扩散并增强其感染能力。由于NA在流感病毒复制和传播中起重要作用, 且其活性中心的氨基酸组成高度保守, 因此是研制抗流感药物的重要靶点。
目前抗流感药物有2种:一种为M2离子通道阻滞剂, 如金刚烷胺, 但是其副作用很大, 而且很容易产生耐药株, 有学者报道现在流感病毒对烷胺类的耐药现象十分严重[ 7, 8]。而2009年甲型H1N1流感病毒对烷胺类耐药情况同样严重, 主要是在NA第31位氨基酸的变异 (S31N)[ 9]。在这种情况下NA抑制剂成为目前抗流感病毒研究的热点[ 10],而且奥司他韦对甲型流感和乙型流感都有效, 不易引起耐药性且耐受性好。但是自从奥司他韦应用于临床以来, 不断有耐药株出现, 耐药率逐年上升, 耐药率在成人为0.4%~1%[ 11],在儿童为4%~8%,其中日本儿童的耐药率高达18%。
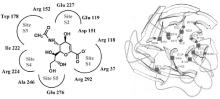
流感病毒NA的活性位点结构示意图见图7[ 12, 13],NA催化位点以及周围相关位点高度保守[ 14, 15]。直接参与催化作用的活性区域有5个, 分别为 S1~S5, S1由3个氨基酸残基 (R118、R292、R371) 组成, S2由2个氨基酸残基 (E227、E119) 组成, S3由2个氨基酸残基 (W178、I222) 组成, S4由3个氨基酸残基 (I222、R224、A246) 组成, S5由2个氨基酸残基 (A246、E276) 组成。间接参与催化作用的位点有R156、Y406、S179、D198、E228、N294、E425等氨基酸位点。
这些位点都直接或间接地参与NA的催化, 所以此处氨基酸如果发生突变, 就会对NA的活性产生影响, 减低流感病毒对NA抑制剂的敏感性, 甚至会导致对NA抑制剂的耐药。通过对本研究分离到的6株甲型H1N1流感病毒的NA基因的测序, 氨基酸序列分析发现部分毒株出现N42S、N59D、Q313K等的氨基酸位点变异, 这些均未涉及NA催化位点。但是在A/Guangdong/ZS03/2010 (H1N1) 毒株中出现E228G氨基酸突变, A/Guangdong/ZS04/2010 (H1N1) 毒株出现E425G氨基酸突变, 这些位点都与NA的活性有关, 但这些毒株其耐药性是否有变化, 有待进一步研究。
同时在A/Guangdong/ZS01/2010 (H1N1) 毒株中出现N222S氨基酸的突变 (虽然与文献报道I222位突变的碱基不一样, 但是222位氨基酸还是存在突变的) 。许多研究表明222位氨基酸的改变会导致流感病毒对NA抑制剂的耐药[ 16]。因此需继续对其耐药性密切监测。
从NA三维结构图中可以看到NA活性位点组成一个疏水性的口袋状结构, 可以结合NA抑制剂奥司他韦等药物, 起到抗病毒的作用。如果疏水性口袋状结构的氨基酸位点发生变异, 会导致无法结合奥司他韦等药物, 则会产生流感病毒耐药株。尽管结构图中只有少部分氨基酸的突变, 但突变位点在NA活性位点上可能对其耐药性产生影响, 需后续试验继续研究。
许多研究表明, 275位氨基酸的变异会对奥司他韦产生耐药[ 17],通过比较分析2010年分离到的甲型H1N1流感病毒, 均未发现275位的变异, 提示在2010年广州散发的甲型H1N1流感病毒对NA抑制剂仍然敏感。2010年分离株NA糖基化位点与2009年代表株比较并没有变化, 与Saxena等[ 18]的报道相同。同时发现2010年分离株与2009年代表株同源性较高 (0.985~0.999),提示NA基因仍是同一来源, 未发生较大变异。对NA系统进化树分析发现, 2009年代表株为一支, 而2010年分离株为一支, 说明2010年与2009年相比,NA基因有部分碱基发生变异。
通过以上分析, NA蛋白275位氨基酸并未出现变异, 提示还没有出现对奥司他韦的耐药株, 但是在NA活性中心周围已经存在有变异的氨基酸, 可能会对其耐药性有影响。同时随着奥司他韦在临床上的广泛应用, 甲型H1N1流感病毒耐药株在世界上其他国家不断有报道, 更应该继续加强对甲型 H1N1流感病毒的耐药性监测以及序列分析工作, 在分子遗传进化分析的基础上, 及时发现有流行病学意义的耐药株, 为国家制定甲型 H1N1 流感防控策略提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|