作者简介:孙旭颖,女,1975年生,学士,中级工程师,主要从事体外诊断试剂及仪器的注册审评工作。
通讯作者:李水军,联系电话:021-54031835。
对液相色谱-串联质谱(LC-MS/MS)检测茶碱进行方法学评价,探讨其在茶碱治疗药物监测(TDM)中的应用。
方法在血清添加放射性核素内标茶碱-D6,经蛋白沉淀稀释后采用LC-MS/MS测定。以Capcell C18 MG Ⅲ(100 mm×2.0 mm,5 μm)为分析柱进行反相色谱分离;以0.1%甲酸乙腈-0.1%甲酸水[20∶80(v/v)]为流动相,流速为0.3 mL/min;以电喷雾离子化串联四级杆质谱、正离子多反应监测进行定量检测。用建立的方法从2008年起连续参加卫生部临检中心茶碱TDM室间质量评价。
结果LC-MS/MS检测茶碱的线性范围为150 μg/mL,批内和批间精密度分别为2.26%~6.65%和4.70%~6.84%,准确度分别为94.14%~104.00%。单个样品的监测分析时间为3.5 min。冻融(-30 ℃↔室温反复解冻3次)、室温放置24 h、自动进样器放置24 h、长期保存(-30 ℃放置28 d)的稳定性均良好。LC-MS/MS测定结果与室间质量评价靶值偏差为2.75%,斜率为1.04,相关系数(
该LC-MS/MS采用放射性内标稀释,具有简单、快速、特异性和灵敏度较好的特点,连续6年测定结果符合全国室间质量评价要求,可用于茶碱的临床TDM。
To perform the methodology evaluation of a liquid chromatography-tandem mass spectrometry (LC-MS/MS) for the determination of theophylline in serum, and to investigate the application significance in the therapeutic drug monitoring (TDM) for theophylline.
MethodsAfter being added with radionuclide theophylline-D6 as internal standard, serum samples were treated with protein precipitation and determined by LC-MS/MS. A reverse phase chromatographic separation was performed on Capcell C18 MG Ⅲ analytical column (100 mm×2.0 mm, 5 μm) by using 0.1% formic acid in acetonitrile and 0.1% formic acid in water [20∶80 (v/v)] as mobile phase. The flow rate was 0.3 mL/min. Theophylline and internal standard were monitored by a positive electrospray ion-tandem mass spectrometry system. The proficiency performance of LC-MS/MS was tested by participation to external quality assessment of theophylline TDM for the National Center for Clinical Laboratory.
ResultsThe linear range of LC-MS/MS for the determination of theophylline was 1-50 μg/mL. The accuracy was 94.14%-104.00% with within-run and between-run precisions of 2.26%-6.65% and 4.70%-6.84%. The run time was 3.5 min per sample. Stabilities were good under 3 cycles of frozen-thaw for 3 times from -30 ℃ to room temperature, room temperature for 24 h, autosampler for 24 h and -30℃ for 28 d. The external quality assessment proficiency test showed the bias of 2.75%, regression slope of 1.04 and correlation coefficient (
The radionuclide internal standard-dilution LC-MS/MS is simple, rapid, specific and sensitive for the determination of serum theophylline. It is comparable with the external quality assessment proficiency test for consecutive 6 years, and it is suitable for theophylline TDM in clinical practice.
茶碱为甲基嘌呤类药物,通过调节环磷酸腺苷途径对支气管平滑肌产生直接松弛作用。上市60多年来,该药物在全世界广泛用于治疗成人慢性阻塞性肺病、哮喘和慢性支气管炎及新生儿呼吸暂停[ 1]。 茶碱的治疗窗窄,毒副作用大,个体差异大,仅凭经验给药经常达不到有效治疗浓度。因此临床治疗时推荐进行治疗药物监测(therapeutic drug monitoring,TDM)[ 2]。目前茶碱检测方法主要是基于免疫学原理。茶碱的肝细胞色素P450代谢物如1-甲基黄嘌呤、3-甲基黄嘌呤、1-甲基尿酸、1,3-二甲基尿酸可能会对免疫法产生干扰,影响结果的准确性[ 3];其它一些与茶碱结构类似的化合物,如咖啡因等可能会对茶碱的测定造成干扰[ 4]。液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)的基本原理是将经适当处理的生物样本先经过高效液相色谱(high performance liquid chromatography, HPLC)分离,然后用串联质谱仪检测2次质荷比(m/z)。LC-MS/MS将HPLC的高效分离能力和质谱的高特异性检测能力进行有机结合。因此在特异性、灵敏度和抗干扰能力方面较其他方法具有明显优势,在临床诊断中发挥着越来越重要的作用[ 5]。我们对LC-MS/MS测定血清茶碱浓度的方法学进行了全面验证,并用该法参加我国卫生部临床检验中心茶碱的室间质评计划,以评价该法准确测定血清茶碱药物浓度的能力以及是否适用于茶碱临床TDM。
3200 QTRAP串联质谱仪(美国Applied Biosystems公司),液相色谱系统(日本岛津公司)由LC-20AD输液泵、DGU-20A3在线脱气仪、SIL-HTc自动进样器组成,Vortex-2涡旋混合器(美国Scientific Industries公司),MIKRO冷冻高速离心机(德国Hettich公司)。
茶碱(批号057K0691,纯度100%)购自Sigma-Aldrich试剂公司,茶碱-D6 (批号7-GHZ-18-1,纯度98%)购自加拿大TRC公司,甲酸、乙腈均为色谱纯试剂,购自美国Tedia公司。茶碱室间质评血清样品由中国卫生部临床检验中心提供。
1.液相条件
分析柱为Capcell C18 MG Ⅲ(5 μm,2.0 mm×100 mm,Shiseido公司);流动相为0.1%甲酸水溶液和0.1%甲酸乙腈[80∶20(v/v)],等度洗脱,流速为0.3 mL/min,进样体积为5 μL。
2.质谱条件
电喷雾(ESI)离子源,正离子检测;GAS1:60,GAS2:50,气帘气:20,碰撞气:高,离子源电压:4 500 V,离子源温度:450 ℃;MRM扫描分析,离子选择通道分别为181.0/124.0 amu(茶碱);187.0/127.0 amu(茶碱-D6)。
3.标准溶液和内标溶液的制备
在空白血清中加入茶碱贮备液,配制成浓度分别为1、2、10、20、50 μg/mL的血清标准液,按样品处理方法处理后进样。取茶碱-D6贮备液,用乙腈稀释成浓度为1 μg/mL的内标工作液,同时作为样品处理时血清蛋白沉淀剂。
LC-MS/MS的性能评价指标包括方法特异性、线性范围和检测灵敏度、精密度、准确度、回收率、基质效应、稳定性等。
1.特异性
考察不同血清中内源性物质对茶碱的干扰情况,取6个不同来源的空白血清,分别配制3和40 μg /mL的茶碱质控样品,按样品处理步骤操作并进样分析。
2.定量限
在LC-MS/MS的临床应用中,通常对定量下限(lower limit of quantification,LLOQ)的要求是准确度80%~120%、精密度( CV)≤20%、信噪比(S/N)≥10[ 6]。
3.精密度和准确度
在空白血清中分别配制浓度为3和40 μg/mL的茶碱质控样品各6份,连续测定3批,计算批内、批间精密度与准确度;同时观察茶碱在1 μg/mL最低定量限的批内精密度和准确度。
4.回收率和基质效应
取低、高浓度质控样品和空白血清各6份,按样品处理方法进行处理,在处理后的空白血清上清液中加入相应浓度的茶碱和茶碱-D6化学品,进样分析,计算质控样品与空白添加相应浓度样品的峰面积百分比,即为样品处理过程的回收率。另取空白添加相应浓度样品与空白溶剂添加相应浓度样品进样比较,计算相应浓度的峰面积百分比,即为基质效应。
5. 稳定性
稳定性可能对检测结果的可靠性、可重复性产生影响,因此有必要对影响稳定性的各种因素(如样品采集、处理、保存等)进行考察,确保在不影响茶碱稳定性允许的条件下进行操作[ 7]。在本实验室的茶碱临床样本测定中,血清样本通常贮存在-30 ℃,考虑到在某些情况下可能需要重测样本,故观察血清从-30 ℃ 到室温解冻3次的冻融稳定性。考虑到在样本前处理时血清需要在室温下放置,故观察血清在室温放置24 h的稳定性。考虑到成批处理后的样本在自动进样器中需等待进样,故观察样品处理后在自动进样器放置24 h的稳定性。考虑到血清样本可能需要长期保存,故观察血清-30℃下保存28 d的稳定性。配制低、高浓度质控血清,在室温放置24 h,经3个-30 ℃冻存至室温解冻循环周期,在-30 ℃条件下冻存放置7、14、21、28 d。与初始状态下相比,观察茶碱在室温、冻融、长期保存条件下的稳定性。
6. 样品处理
取50 μL血清,加入150 μL含1 μg/mL茶碱-D6内标的乙腈溶液,涡旋振荡10 s,20 000× g离心3 min,上清液用水稀释4倍后进样测定茶碱含量。
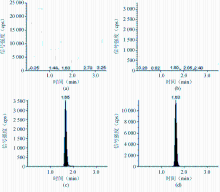
本研究曾尝试了不同类型的分析柱对茶碱及内标的峰形、保留时间的影响,Capcell C18 MG Ⅲ对茶碱具有嘌呤结构的药物有比较强的保留,峰形对称性更好。在本研究的水-乙腈-甲酸流动相系统下,茶碱的典型保留时间为1.65 min,内标为1.63 min,总的色谱分析时间为3.5 min,在空白血清样品中未见对茶碱和内标有干扰的色谱峰,其色谱图见 图1。
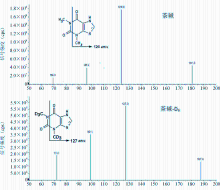
茶碱在电喷雾(electrosprayionization,ESI)离子化方式下,主要形成[M+H]+ m/z 181.0的分子离子。选择性对分子离子碎裂进行二级质谱分析,主要形成m/z 124.0、m/z 96.2和m/z 69.3等碎片离子。选择m/z 181.0/124.0作为定量分析时监测的离子通道,同时选择m/z 181.0/96.2和m/z 181.0/69.3作为定性离子通道。内标茶碱-D6的质谱行为与茶碱相似,形成m/z 187.0的分子离子,碎裂后的二级质谱图形成m/z 127.0、m/z 99.1和m/z 72.0的碎片离子。茶碱及内标的碎片离子图见 图2。
在茶碱和内标茶碱-D6保留时间均未见内源性物质的干扰,3和40 μg /mL的茶碱质控样品准确度为93.6%~105.7%,精密度采用变异系数( CV)来表示, CV为0.85%~4.56%。
以添加浓度为X轴,样品与内标物的峰面积比为Y轴,进行线性回归,经“1/X”权重得回归方程为 Y=0 .239 X+0.068 2, r=0.998 9。结果表明,茶碱在150 μg/mL血清浓度范围内线性关系良好,血清中茶碱的LLOQ为1 μg/mL。茶碱在LLOQ (1 μg /mL)时,本法批内准确度为92.2%,批内 CV为8.32%,见 表1;其信噪比(signal to noise,S/N)为433.9,见 图1。
同时观察茶碱在LLOQ(1 μg/mL)时的批内精密度和准确度以及3、40 μg/mL茶碱质控样品的批内、批间精密度与准确度,结果见 表1。
样品在冻融(-30 ℃↔室温反复解冻3次)、室温放置24 h、自动进样器放置24 h、长期保存(-30 ℃放置28 d)条件下,准确度为85%115%,精密度( CV)<15%。见 表2。
| 表2 茶碱在室温放置24 h、冻融、自动进样器放置24 h、长期保存的稳定性 |
将本研究建立的LC-MS/MS参加了2008年至2014年上半年卫生部临床检验中心全国TDM室间质评计划。该计划1年2次,每次提供5个血清盲样。在规定室间内将测定结果上报,卫生部临检中心反馈每次检测统计结果。由参与TDM室间质评计划的临床实验室(2014年为68个实验室)按照方法学分组的检测均值确定茶碱的靶值。测定结果在靶值的25%内视为可接受结果。将本研究建立的LC-MS/MS的测定结果与靶值进行线性回归分析,回归斜率为1.04,相关系数( r2)为0.983,和靶值的平均差异为2.75%( n=60)。LC-MS/MS结果和靶值之间的回归方程为 YLC-MS/MS= 1.04 X靶值-0.21,偏差(±2 s)为-11.4%~16.9%。见 图3。
茶碱的有效血药浓度安全范围很窄,有明显的个体差异,可能与其他药物相互作用,因此临床上推荐进行临床TDM,以达到理想的治疗效果,避免可能的毒性反应[ 8, 9]。茶碱的药理作用与血药浓度密切相关,其治疗范围血清浓度为1020 μg/mL。有研究发现,有近三分之二患者的茶碱浓度超出治疗范围[ 10]。茶碱血药浓度高于25 μg/mL时可能出现副作用。由于有茶碱水平非常高而导致惊厥甚至死亡的报道[ 8, 11],所以茶碱一直是血药浓度监测的主要药物之一。因此,建立一个准确可靠的茶碱检测方法极为关键。
目前已有多种方法[如免疫法、荧光偏振免疫法(fluorescence polarization immunoassay, FPIA)、高效液相色谱法、吖啶酯直接化学发光法、酶增强化学发光法、酶扩大免疫法、微粒子酶免疫分析法等)用于检测茶碱浓度。这些方法主要是基于免疫学原理。自动化系统的化学发光免疫法测定茶碱由于采用抗原—抗体免疫反应,因此包含了免疫化学反应和化学发光反应两个部分,主要原理是将化学发光物质或酶标记在抗原或抗体上,经过抗原与抗体特异性反应形成抗原-抗体免疫复合物。这种方法无法直接检测茶碱本身,其底物检测必须依赖一系列的免疫反应,这使得它容易受血清内源性物质的干扰[ 12]。FPIA不需要预处理样品,检测快速。FPIA仪器在现阶段较为便宜及易得,是临床常用方法之一[ 13]。HPLC是茶碱测定的常用方法,为了避免干扰, HPLC需要长时间的色谱分离[ 14, 15]。气相色谱质谱法(GC-MS)实现了更高灵敏度的茶碱定量,但是样品处理采用衍生化方法,比较繁琐[ 16, 17, 18]。LC-MS/MS近年来已成为临床药物分析和临床检验的一个强大的分析工具,由于其卓越的特异性、灵敏度和多化合物检测能力,在许多临床实验室都有应用[ 5, 19, 20]。已有的LC-MS/MS方法比较复杂,同时测定多个目标化合物,与单个茶碱测定方法相比,需要更长的运行时间[ 21, 22, 23]。室间质评是实验室质量控制的有效方法,对于衡量临床实验室不同方法(特别是新建方法)检测结果的质量和可比性尤为重要[ 24]。
本研究采用LC-MS/MS检测血清茶碱浓度。方法学验证结果表明,不同来源的血清对测定结果的影响基本一致,本方法具有较好的专一性;LLOQ为1 μg/mL,灵敏度非常高;测定结果精密、准确,能满足血清样品中茶碱浓度监测的需要;回收率高,基质效应对测定结果的影响较小;室温保存、冻融、自动进样器保存及长期的稳定性均较好。LC- MS/MS结果和室间质评靶值间不存在浓度依赖性的偏差。LC-MS/MS测定结果与靶值非常接近,能准确测定血清茶碱浓度。相对而言,LC-MS/MS比GC-MS/MS在操作和处理上要简单,临床实用性更高。本研究采用LC-MS/MS,样品处理采用简单的蛋白沉淀法,只需要50 μL血样,每份样品的色谱分析时间为3.5 min,从而实现简单、快速、高通量的检测。本研究对该法进行了包括特异性、线性、精密度、准确度、回收率、基质效应、稳定性等内容的全面方法学验证,符合生物分析方法的国际规范[ 7]。从2008年起,用该法连续参加卫生部临床检验中心组织的茶碱TDM的室间质评,与靶值的偏差控制在±20%内,平均偏差为2.75%,显示出良好的准确性和可比性。由此可见,LC-MS/MS不但可为茶碱的临床TDM提供服务,同时亦可为临床TDM建立质控方法。但现阶段由于技术方法所限,室间质评只能采用不同方法分组,比较彼此的接近程度,通常取组内均值作为靶值,但并不代表样本的真实(正确)结果,即存在多数参加者结果错误,少数参加者结果正确反而错判的风险[ 25]。而采用特异性和准确性更好的方法如LC-MS/MS建立参考方法,给标准参考物质(standard refence materials,SRMs)赋值,评价方法的准确性,开展正确度验证是今后室间质评的发展方向。
致谢:感谢北京医院临床检验科董军老师对本文修改提出的建设性意见。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|