晏峰,男,1975年生,硕士,副主任技师,主要从事生化检验工作。
探讨肝硬化患者血清血管紧张素转化酶(ACE)及C反应蛋白(CRP)的变化。
方法检测275例肝硬化患者及241名健康体检者(对照组)血清ACE活性和CRP水平。肝硬化患者按肝功能Child-Pugh分级标准分为A级(96例)、B级(118例)和C级(61例)。以ACE活性>65 U/L、CRP>10 mg/L为阳性判断值,比较2组之间的阳性率。将所有研究对象分为低CRP(≤10 mg/L)组(306例)和高CRP(>10 mg/L)组(210例),比较2组患病率;将275例肝硬化患者分为高ACE(≥65 U/L)组(158例)和低ACE(<65 U/L)组(117例),比较2组CRP水平。血清ACE活性与CRP水平相关性分析采用直线相关分析。
结果肝硬化组A、B、C 3级ACE活性及CRP水平均高于对照组(
肝硬化的发生、发展伴随着ACE和CRP的变化。炎症和高ACE状态在肝硬化发生、发展中起重要作用。
To investigate the changes of serum angiotensin-converting enzyme (ACE) and C reactive protein (CRP) in liver cirrhosis patients.
MethodsA total of 275 patients with liver cirrhosis and 241 healthy subjects (control group) were enrolled, and their serum ACE activities and CRP levels were determined. The patients with liver cirrhosis were classified into Class A (96 cases), Class B (118 cases) and Class C (61 cases) groups according to liver function Child-Pugh classification standard. ACE activity>65 U/L and CRP level >10 mg/L were as positive judgment values, and the positive rates between the 2 groups were compared. All the subjects were classified into low CRP (≤10 mg/L) group (306 cases) and high CRP (>10 mg/L) group (210 cases), and the prevalence rates between the 2 groups were compared. The 275 patients with liver cirrhosis were classified into high ACE (≥ 65 U/L) group (158 cases) and low ACE (<65 U/L) group (117 cases), and the CRP levels between the 2 groups were compared. Serum ACE activities and CRP levels were analyzed by linear correlation analysis.
ResultsThe serum ACE activities and CRP levels were higher in Class A, B and C groups than in the control group (
The occurrence and development of liver cirrhosis associate with the changes of ACE and CRP. Inflammation and high ACE status play important roles in occurrence and development of liver cirrhosis.
有研究显示肝硬化的发生、发展存在局部肾素-血管紧张素-醛固酮系统(RAAS)变化[ 1, 2],血管紧张素转化酶(angiotensin-converting enzyme,ACE)在其中发挥重要作用。肝硬化的进展过程同时也伴随着炎症变化。C反应蛋白(CRP)是亚临床炎症标志之一,也是脏器发生硬化性疾病的介质。为此,我们探讨了肝硬化患者ACE活性及CRP水平的变化。
1. 肝硬化组
选取2012年1月至2012年6月丽水市人民医院肝科门诊和住院并确诊为肝炎后肝硬化的患者275例,其中男192例,女83例,年龄38~66岁,所有患者乙型肝炎表面抗原(HBsAg)均为阳性,且均排除合并有继发感染、肝脏占位性病变、门静脉血栓形成、肝内胆管扩张及长期酗酒者。将肝硬化患者按肝功能Child-Pugh分级标准分为A、B、C 3级,其中A级96例、B级118例、C级61例。
2. 对照组
随机选取丽水市人民医院体检中心健康体检者241名,其中男152例,女89例,年龄23~66岁,超声检查无脂肪肝,无慢性病毒性肝炎、酒精性肝炎、肝硬化或其他严重躯体性疾病史。
1. 样本留取
所有研究对象采集清晨空腹静脉血3 mL,分离血清后-20 ℃保存待测。
2. 试剂和仪器
ACE试剂由温州伊利康公司提供(批号111102);CRP试剂由四川迈克公司提供(批号1211061)。检测均在Olympus AU5421全自动生化分析仪上进行。
3. 测定方法
CRP采用免疫透射比浊法检测。ACE活性采用连续监测法检测,基本原理为样品中ACE催化呋喃酰基-L-苯丙氨酰甘氨酰甘氨酸水解,生成苯丙氨酰基和双苷肽,引起340 nm处吸光度下降,吸光度下降速率与ACE活性成正比。
4. 参考区间
根据本实验室设定的参考区间:ACE为16~65 U/L,CRP为0.0~10.0 mg/L。
采用SPSS 13. 0统计软件。符合正态分布计量资料用 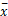
肝硬化组A、B、C 3级ACE活性及CRP水平均高于对照组( P<0.01),且肝硬化组A、B、C 3级ACE活性及CRP水平依次增高,各级间差异均有统计学意义( P均<0.01)。见表1:
| 表1 4组血清ACE活性与CRP水平比较 |
以ACE活性>65 U/L为阳性判断值,肝硬化组阳性率为74.5%,对照组为5.4%,2组间差异有统计学意义(χ2=251.7, P<0.01)。
以CRP>10 mg/L为阳性判断值,肝硬化组阳性率为68.7%,对照组为8.7%,2组间差异有统计学意义(χ2=191.7, P<0.01)。
以血清CRP=10 mg/L为截点[ 3],将所有研究对象分为低CRP(≤10 mg/L)组(306例)和高CRP(>10mg/L)组(210例)。高CRP组中肝硬化患病率为90.0%(189/210),低CRP组中肝硬化患病率为28.1%(86/306),前者患病率是后者的3.2倍。以低CRP组为参照组,高CRP组肝硬化患病风险的优势比( OR)=7.937(95% CI:6.132~10.530, P<0.01)。
以ACE=65 U/L为截点,将275例肝硬化患者分为高ACE(≥65 U/L)组(158例)和低ACE(<65 U/L)组(117例)。高ACE组血清CRP水平[28.6(14.8~86.3)mg/L]明显高于低ACE组[15.5(4.3~42.7)mg/L]( P<0.01)。
血清ACE活性与CRP水平呈正相关,回归方程为 Y=1 .715 X+13.77, r=0.468, P<0.01。
ACE是细胞内普遍存在的金属蛋白酶,为血管紧张素Ⅰ(AngⅠ)转变为血管紧张素Ⅱ(AngⅡ)的限速酶,是调节RAAS与缓激肽系统的重要酶[ 4]。Rao[ 2]的研究发现肝硬化患者血肾素-血管紧张素系统(RAS)异常激活,一方面在于外周血管扩张,有效循环血量不足导致RAS活跃、AngⅡ增加;另一方面AngⅡ表达的变化受肝脏功能影响,肝脏损伤的局部反应或者存在RAS系统。Yoshiji等[ 5]的研究证实未经治疗的肝硬化患者ACE活性显著升高。本研究结果显示肝硬化组ACE阳性率远高于对照组( P<0.01),且肝硬化A、B、C级患者血清ACE活性依次增高( P均<0.01),表明随着肝硬化患者肝功能损伤程度的加重,血清ACE水平也呈现出逐渐升高。推测肝硬化患者可能存在RAS持续过度激活,这与Bataller等[ 6]认为活化人体肝星状细胞能表达RAS和合成AngⅡ结果相一致。而AngⅡ是RAS的主要活性物质,能够刺激转化生长因子-β(TGF-β)的合成和分泌[ 7]。TGF-β能诱导肝细胞凋亡,抑制肝细胞再生,活化储脂细胞,抑制肝外基质降解,促进肝细胞外基质合成增加,调节细胞外受体表达,促进肝纤维化、肝硬化的发生、发展[ 7]。
肝硬化患者血清ACE升高的机制未完全明确,可能与以下因素有关:(1)ACE主要在肝脏代谢,肝硬化状态时肝功能低下,对ACE的有效清除减少;(2)机体在肝硬化炎症状态TGF-β合成和分泌增加,上调血管内皮细胞受体,促进血管内皮细胞增生,导致释放更多的ACE入血;(3)肝硬化患者存在局部RAS持续过度激活;(4)肝硬化门脉高压形成后,一方面肺内分流增加,出现低氧血症,刺激ACE释放,另一方面ACE灭活作用减弱。近年有文献[ 8]报道ACE抑制剂培哚普利(PE)与干扰素组合治疗,可完全阻止肝纤维化的发展,而且PE的作用显著强于干扰素。有研究证实ACE抑制剂可以延缓大鼠肝纤维化进程,减轻肝细胞的损伤[ 9]。
本研究结果显示肝硬化患者患病率会随着血清CRP水平的升高而增加,伴随着肝损伤程度和炎症活动的加剧,血清CRP水平出现明显变化。这与慢性HBV患者由于肝脏受损,出现不同程度的肝细胞坏死,引起机体炎症反应,导致肝细胞合成CRP增加;且随着疾病的不断发展,肝硬化和肝癌患者肝损害进一步加重,肝细胞合成CRP也发生相应变化的结论[ 10]相符合。CRP是急性时相反应蛋白(APP)中最重要的蛋白之一。而这种应激时APP产生的机制目前认为主要是在应激状态下,肝细胞及间质细胞特别是肝星状细胞中的核因子-κB(NF-κB)被激活后进入核内,与许多细胞因子及炎症介质基因5'端调控区的κB序列结合而启动这些基因的转录,使其血浆水平明显升高。细胞因子产生增多后,通过细胞内信号转导途径(具体途径目前并不完全清楚),刺激肝细胞与肝星状细胞产生及释放APP[ 11]。已知白细胞介素-1(IL-1)、白细胞介素-6(IL-6)及肿瘤坏死因子(TNF)等细胞因子能诱导CRP急速上调。创伤引起肝星状细胞产生IL-1,肝损伤后患者少量的IL-1增加也可引起显著的代谢反应[ 12]。与低CRP组相比,高CRP组肝硬化患病风险的 OR为7.937(95% CI:6.132~10.530, P<0.01)。也说明肝硬化肝损伤后CRP明显升高。CRP升高可能是由肝细胞及肝星状细胞分泌大量炎症因子刺激产生,而这种变化可能导致肝细胞及肝星状细胞结构、功能和代谢的改变。
本研究还证实高ACE活性的肝硬化患者血清CRP水平明显高于低ACE活性患者( P<0.01),二者间具有一定的正相关( r=0.468, P<0.01)。如能对肝硬化患者同时进行针对性抑制ACE活性及降低炎症反应,阻缓其进展,对于治疗及愈后具有一定的临床意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|

