作者简介:梁华,男,1975年生,硕士,主管技师,主要从事细胞免疫学研究。
通讯作者:李柏青,联系电话:0552-3171086。
建立用流式细胞术(FCM)检测人外周血产白细胞介素22(IL-22)的不同淋巴细胞亚群的方法,并探讨其在结核病(TB)患者中的应用,以了解产IL-22的淋巴细胞亚群在抗结核感染免疫中的作用。
方法采集22例TB患者和18名健康对照者外周血,与相同体积RPMI-1640培养液混匀,加入佛波醇酯(PMA)和钙离子霉素,混匀后于37 ℃ 5% CO2静置培养2 h,再加入莫能霉素后继续培养4 h,收集细胞,用荧光素标记进行细胞表面抗原和胞内细胞因子染色,用FCM检测表达IL-22、IL-17的不同淋巴细胞亚群比例。
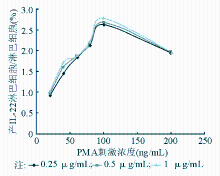
结果PMA浓度为100 ng/mL,钙离子霉素浓度为1 μg/mL,刺激培养2 h可最有效刺激IL-22的产生;TB患者外周血中产IL-22的γδT细胞比例(7.37%)明显高于正常人(1.81%,
建立了一套简便、完整、可靠的FCM检测产IL-22的淋巴细胞亚群的方法,产IL-22的γδT细胞在抗结核感染免疫中可能发挥免疫效应。
To establish a method of detecting different interleukin 22 (IL-22) producing lymphocyte subpopulations in human peripheral blood by flow cytometry (FCM),and investigate its application in patients with tuberculosis (TB) and realize the role of IL-22 producing lymphocyte subpopulations in anti-infection immunity against TB.
MethodsPeripheral blood samples collected from 22 TB patients and 18 healthy controls were mixed with RPMI-1640 culture medium at the scale of the same volume. After adding phorbol ester (PMA) and calcium ionomycin mixed for 2 h culturing on the conditions of 37℃ and 5% CO2,monensin was added and continued being cultured for 4 h. The cells were collected and stained surface molecular or intracellular with fluorochrome-conjugated monoclonal antibodies. The respective proportions of different IL-22 and IL-17 producing lymphocyte subpopulations were detected by FCM.
ResultsThe condition that the concentration of PMA was 100ng/mL and that of ionomycin was 1μg/mL with 2 h being stimulated and cultured could produce IL-22 effectively. The proportions of IL-22 producing gamma delta T cells in TB patients (7.37%) were obviously higher than those in healthy controls (1.81%,
The established easy,complete and reliable method for the detection of IL-22 producing lymphocyte subpopulations and IL-22 producing gamma delta T cells could act immunological effects in anti-infection immunity against TB.
白细胞介素22(IL-22)是在1999年被报道发现的一种炎性细胞因子[ 1],可由多种免疫细胞和组织分泌,对于慢性炎症性疾病和自身免疫性疾病的发生具有重要的调节作用[ 2, 3, 4, 5]。虽然近年发现的Th17细胞以分泌白细胞介素17(IL-17)和IL-22等细胞因子为特征,参与了多种炎症性疾病和自身免疫性疾病的发生、发展,但新近又有报道,以分泌IL-22为主要特征的Th22细胞在机体感染病毒或细菌等病原体后,可以激活其他免疫细胞,并且帮助机体控制炎症、对抗感染[ 6]。为了解人外周血不同淋巴细胞亚群内表达IL-22、IL-17和共表达IL-22与IL-17的淋巴细胞比例以及他们在抗结核感染免疫中的作用,我们采用病例对照研究的方法,用流式细胞术(FCM)测定了健康个体和结核病(TB)患者外周血中不同淋巴细胞亚群IL-22、IL-17阳性细胞的比例。
1. 标本来源
健康对照者(18名,年龄1860岁,平均年龄32岁)均为蚌埠医学院附属医院健康教工,其胸部X透视正常且近期无接触TB史;TB患者(22例,年龄1877岁,平均年龄45岁)外周血标本来自蚌埠市传染病医院,其临床诊断符合2001年中华医学会结核病学分会肺结核诊断和治疗指南标准,每份标本的采集均征得本人书面同意。
2. 试剂与仪器
(1)主要试剂:抗CD3-别藻蓝蛋白(APC)、抗CD8-藻红蛋白花青苷5.5(PeCy5.5)、抗CD19-PeCy5.5、抗CD8-藻红蛋白花青苷7(PeCy7)、抗T细胞受体γδ(TCR-γδ)-花青苷(TC)、抗-TCR-γδ-异硫氰酸荧光素(FITC)均购自Invitrogen公司,抗IL-22-藻红蛋白(PE)购自R&D公司,抗CD56-APC、抗IL-17-FITC均购自eBioScience公司,与抗IL-22相匹配的IgG1-PE同型抗体和与抗IL-17相匹配的IgG1-FITC同型抗体均购自Invitrogen公司,以上各抗体均为小鼠抗人单克隆抗体,使用时参照相应说明书并预先做效价滴定后确定使用量;(2)其他试剂:激活剂,佛波醇酯(PMA)用二甲基亚砜(DMSO)配制成储存液(0.2 mg/mL),少量分装-80 ℃冻存,使用时用RPMI-1640液做1∶10稀释;协同刺激剂,钙离子霉素(ionomycin)用乙醇配制成储存液(0.5 mg/mL),PMA、钙离子霉素、DMSO均为Sigma公司产品;蛋白转运抑制剂,莫能霉素(monensin)为eBioScience公司产品;RPMI-1640为Gibco公司产品;新生牛血清(NBS)为杭州四季青生物公司产品;溶血剂为BD公司产品;透膜剂,称取100 mg Saponin(Sigma公司产品),溶于100 mL 10% NBS-0.1% NaN3的磷酸盐缓冲液 (PBS)中;固定剂,2%多聚甲醛(PFA)的PBS溶液;染色缓冲液(SB),含50 mL/L NBS-0.1%NaN3的PBS溶液,4 ℃保存;(3)仪器:FACS Calibur和FACS Aria流式细胞仪为美国BD公司产品,CO2培养箱为美国Harris公司产品;低温离心机Eppendorf 5810R为德国Eppendorf公司产品。
1. 标本的采集
空腹采集静脉血2 mL于肝素钠抗凝管中,混匀备用。
2. 细胞培养
(1) 不同的PMA和钙离子霉素浓度对外周血的刺激培养:取肝素抗凝全血9 mL,加RPMI-1640培养液9 mL混匀后,分别加到24孔培养板内分成6孔×3组共18孔进行培养,每孔1 mL,然后分别向每组的6孔依次加1∶10稀释的PMA工作液1、2、3、4、5和10 μL,同时依次向每组加入钙离子霉素0.5、1和2 μL,37 ℃ 5%CO2静置培养2 h后,再向每孔加莫能霉素1 μL(终浓度2.0 μmol/L),混匀后继续培养4 h;(2)不同的诱导时间对外周血的刺激培养:取肝素抗凝全血3 mL,加RPMI-1640培养液3 mL,分别加到6块24孔培养板内共6孔进行培养,每孔1 mL,然后分别在每孔加1∶10稀释的PMA工作液5 μL,钙离子霉素2 μL,37 ℃ 5%CO2分别静置培养0.5、1、2、3和4 h后,再向每孔加莫能霉素1 μL(终浓度2.0 μmol/L),混匀后继续培养4 h。
3. 淋巴细胞表面抗原及胞浆内细胞因子染色
收集培养后的全血,在4 ℃ 1 400× g离心8 min,吸弃上层血浆,吸取压积红细胞层100 μL到各流式管中,依次加入抗人CD3-APC、CD8-PeCy5.5、TCR-γδ-FITC或抗人CD3-FITC、CD19-PeCy5.5、CD56-APC或抗人CD3-APC、CD8-PeCy7、TCR-γδ-TC,混匀后4 ℃避光反应20 min。加入1∶10稀释溶血剂每管2 mL,混匀,室温避光10 min,500× g离心5 min后弃上清液,每管加入SB 1 mL,洗涤2次,用2%PFA每管500 μL 4 ℃固定30 min,经洗涤后加入透膜剂每管500 μL,4 ℃避光10 min后,725× g离心7 min,弃上清,每管加入小鼠血清5 μL和10%牛血清白蛋白(BSA)20 μL,4 ℃封闭30 min。加入抗人IL-22-PE 5 μL或抗人IL-17-FITC 1 μL于检测管内,同型对照管加入相应匹配的抗人mIgG1-PE或mIgG1-FITC,避光冰浴30 min,再分别用上述透膜剂和SB 725× g 7 min各洗1次,加200 μL 2% PFA重悬细胞,利用流式细胞仪检测分析,每管收集8万10万个细胞数据。
4. 数据分析
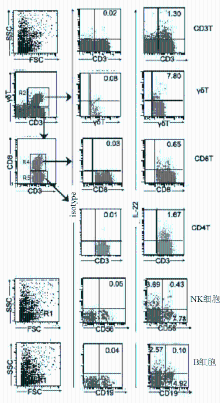
应用Calibur仪器CellQuest软件进行四色分析:在前向散射光-侧向散射光(FSC-SSC)点阵图上设定淋巴细胞R1,然后以γδ-FITC和CD3-APC作图,分别设定γδT细胞为R2、γδ-CD3+(αβT)细胞为R3,在γδ-FITC和IL-22-PE点阵图设定G2=R1*R2,分析γδT细胞门内IL-22+细胞比例;再以CD8-PeCy5.5和CD3-APC作图,分别设定CD8+T细胞为R4、CD8-CD3+(CD4)T细胞为R5,在CD8-PeCy5.5和IL-22-PE点阵图设定G4=R4*R3*R1,分析CD8 T细胞门内IL-22+细胞比例;再在CD3-APC和IL-22-PE点阵图设定G5=R5*R3*R1,分析CD4 T细胞门内IL-22+细胞比例,以同样方法设门分析B细胞和NK细胞门内IL-22+细胞比例;应用Aria仪器Diva软件进行五色分析,分析方法与四色相似,分别对CD3、CD4、CD8、γδT细胞门内IL-22+细胞和IL-17+细胞进行分析;以同型对照抗体染色管设定阴性区域,各测定管阳性率减去同型管即为特异性阳性率。
采用SPSS 16.0软件进行统计分析,数据以 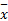
1.最佳PMA和钙离子霉素浓度的选择 不同的PMA和钙离子霉素浓度梯度组合对淋巴细胞产生IL-22的影响较大( P<0.05),PMA为5 μL (终浓度100 ng/mL)、钙离子霉素为2 μL(终浓度1 μg/mL)的刺激条件下,产生IL-22的淋巴细胞比例为2.78%,随着PMA和钙离子霉素浓度的增大,产生IL-22的淋巴细胞比例出现先增大后减小的趋势,并且PMA浓度和钙离子霉素浓度组合的交互效应有统计学意义( P<0.05),表明确定PMA和钙离子霉素的最佳浓度组合可最大程度发挥其协同刺激的效率。见 图1。
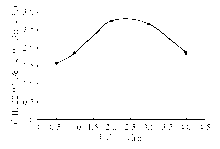
2.最佳刺激时间的选择 不同的刺激培养时间对淋巴细胞产IL-22的效率不同,刺激2 h后产IL-22的淋巴细胞比例最大(2.78%, P<0.05),随着培养时间的增大,产IL-22的淋巴细胞比例同样出现先增大后减小的趋势,表明在培养条件下刺激时间过短或过长都不利于细胞因子的分泌。见 图2。
在人类外周血中的淋巴细胞各个亚群均有产生IL-22的阳性细胞存在,见 图3,图中isotype为对应的同型抗体。通过健康对照者和TB患者的对比检测发现,TB患者外周血中分泌IL-22的γδT细胞比例(7.37%)明显高于正常人(1.81%, P<0.05);而在CD4+T、CD8+T、自然杀伤(NK)细胞和B细胞等其他细胞亚群中,分泌IL-22的阳性细胞比例在TB患者和健康对照者之间差异均无统计学意义( P>0.05),见 表1。
| 表1 TB患者和健康对照者外周血各淋巴细胞亚群中分泌IL-22的阳性细胞比例 |
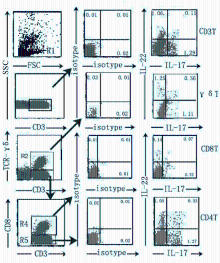
由于IL-22和IL-17均为Th17细胞的重要效应分子。IL-22同时也是Th22细胞的主要效应分子。为深入探讨分泌IL-17和IL-22的T细胞亚群的关系,我们对其中部分健康对照者和TB患者进一步检测了在T细胞各亚群中分泌IL-22和IL-17的细胞比例,见 图4,图中isotype为对应的同型抗体。结果表明,在T细胞各亚群中均可以检测到一定比例的共分泌IL-22和IL-17 的细胞群体,健康对照者与TB患者比较差异均无统计学意义( P>0.05),无论Th22还是Th17细胞,健康对照者与TB患者比较差异均无统计学意义( P>0.05)。见 表2。
| 表2 健康对照者和TB患者外周血中T细胞各亚群中分泌IL-22和IL-17的阳性细胞比例 |
Th1和Th2细胞亚群的理论最早在1989年由Mosmann等[ 7]提出,Th17细胞则在2005年被发现[ 8],其分泌IL-17、IL-17F、白细胞介素21(IL-21)、IL-22,在组织炎症和自身免疫性疾病中发挥重要的作用[ 9]。2009年,Th22细胞被发现[ 6],尽管目前对该T细胞亚群的认可尚有争议,但研究发现该群细胞能够激活其他免疫细胞,控制机体的炎症反应,在监督和协调引起炎症的免疫细胞过程中发挥特殊的作用。IL-22作为Th22细胞分泌的重要细胞因子对组织发出预警,使组织做好识别和攻击病原体的准备,并且其在调节上皮细胞的组织修复、参与多种自身免疫性疾病的发生、对感染性疾病的促炎或抗炎作用等均具有广泛的生物学活性[ 10]。
本研究旨在用FCM的方法建立一套完整的检测IL-22的方案,并探讨其在TB患者中的应用。淋巴细胞通常在静止状态下很少或不分泌IL-22,因而在体外必须使用PMA和钙离子霉素刺激培养诱导其分化,才能对细胞因子进行检测。PMA和钙离子霉素刺激浓度一般在2050 ng/mL和0.51 μg/mL之间[ 11],但分泌不同的细胞因子,PMA和钙离子霉素会有相应的最佳浓度梯度组合。作为活化信号激活剂,PMA起主要刺激作用,钙离子霉素起协同刺激作用,本研究显示PMA为100 ng/mL、钙离子霉素为1 μg/mL的条件下能最有效地刺激淋巴细胞分泌IL-22,继续增加浓度则可能会因为PMA的毒副作用加大而造成细胞不能耐受。对于刺激时间的选择,结果显示刺激2 h与刺激3 h差异无统计学意义( P>0.05),但刺激2 h与刺激0.5、1、4 h则差异有统计学意义( P<0.05),刺激时间过短或过长都不利于IL-22的最大化分泌,考虑试验时间上的合理安排,选择刺激培养2 h为宜。
由于多数人的CD4抗原会因PMA的激活而有不同程度的下降,如果直接用CD4作表面标记会对分析CD4+T细胞亚群结果有影响[ 12]。因此本研究采用CD3T、CD8T、γδT同时表染的策略间接确定CD4+T细胞亚群,再搭配一种细胞因子如IL-22进行四色测定,或2种细胞因子如IL-22和IL-17进行五色测定的方法,不仅可以避免CD4表面抗原下调对测定的影响,而且可以很明确地确定CD3T、CD8T、γδT、CD4T、NK细胞以及B细胞中IL-22+细胞或IL-17+细胞的比例,同时清楚地显示在CD4+细胞亚群中,分别产生IL-22和IL-17以及共表达IL-22和IL-17的阳性细胞比例,只有CD4+同时IL-22+IL-17-的淋巴细胞亚群,才是Th22细胞;而CD4+同时IL-17+的淋巴细胞亚群,才是Th17细胞。
临床TB是一个T细胞介导的免疫性疾病。既往研究表明,CD4+T细胞、CD8+T细胞以及γδT细胞均参与抗结核感染免疫[ 13],但目前分泌IL-22的淋巴细胞亚群在抗结核感染免疫中的作用报道并不多。本研究显示,人外周血分泌IL-22的淋巴细胞主要来源于CD4+T细胞、CD8+T细胞、γδT细胞、NK细胞和B细胞,这与Zheng等[ 14]报道的IL-22的细胞来源是相吻合的,而分泌IL-22的γδT细胞比例在TB患者中升高( P<0.01)。这一结果使得IL-22作为一种炎性因子的生物学作用与γδT细胞的抗结核分枝杆菌的固有免疫效应有机结合,该结果与Yao等[ 15]报道的在非人灵长类动物模型中,结核分枝杆菌感染可以导致合成IL-22的T细胞数量明显升高的观点相符合。本研究还显示,在T淋巴细胞各亚群中均可以检测到共分泌IL-22和IL-17的细胞,未发现TB组和健康对照组之间存在差异( P>0.05)。Scriba等[ 16]认为分泌IL-22或IL-17的CD4+T细胞可能在抗结核分枝杆菌免疫反应中起重要作用,他们用卡介菌(BCG)或结核菌素(PPD)作为抗原刺激剂检测发现,TB患者外周血中表达IL-22和IL-17的CD4+T细胞的比例较健康对照者降低;而本研究结果显示Th22和Th17细胞在TB患者和健康对照者之间差异无统计学意义( P>0.05)。原因可能在于:一是刺激剂不同,本研究所用的PMA和钙离子霉素是一种活化信号刺激剂,其结合并激活蛋白激酶C(PKC),并随后导致一系列的细胞响应,引起T细胞的激活,而BCG或PPD抗原刺激引起的T细胞活化更可能是从TCR-CDR3构型改变导致相关基因表达上调引起,而这种表达上调的差异性存在于TB患者和健康对照者之间。此外,Scriba等选用长期暴露于结核分枝杆菌环境中但不发病的健康个体作为对照,从而可能使得更多的CD4+T记忆细胞参与细胞因子的分泌与表达。
总之,TB的发生是结核分枝杆菌和宿主免疫细胞相互作用的一个复杂过程,产IL-22的不同淋巴细胞亚群尤其T细胞亚群在抗结核感染免疫或致病机制中的作用以及受何种条件和调控机制产生IL-22仍需要深入探讨,这对于了解TB的发病机制和制定防治措施都具有学术理论和临床实际意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|