作者简介:王明丽,女,1984年生,技师,主要从事分子生物学检验工作。
通讯作者:李 智,联系电话:021-66306831。
探讨miR-34a在肾癌组织中表达、miR-34a对人肾癌ACHN细胞增殖和侵袭的影响及调控机制。
方法实时聚合酶链反应(PCR)检测miR-34a在20例肾癌及癌旁组织中的表达;采用脂质体转染法将miR-34a mimics转染入肾癌ACHN细胞中,试验分空白对照组、阴性对照组、miR-34a mimics 转染组。实时PCR检测转染24 h后miR-34a表达量;噻唑蓝(MTT)试验检测细胞增殖;流式细胞术检测细胞周期;Transwell及Matrigel检测细胞侵袭能力;实时 PCR和蛋白质印迹(Western blot)技术检测转染后转录因子YY1表达水平。
结果与癌旁组织相比,20例癌组织中miR-34a平均表达量为1.06±0.67,显著低于癌旁组织(1.62±0.83, P<0.01);转染后24 h, miR-34a mimics转染组的miR-34a表达量为157.04±13.01,较阴性对照组显著上调( P<0.01);miR-34a mimics转染组细胞增殖能力显著降低( P<0.01),细胞生长被阻滞在G0/G1期;细胞侵袭能力明显减弱( P<0.01);转染miR-34a mimics后 YY1基因在mRNA表达无明显变化( P>0.05),蛋白水平下调。
结论miR-34a在肾癌中低表达,可能与肾癌的发生有关;miR-34a调控YY1的表达可能是抑制肾癌细胞生物活性的重要机制之一。
To investigate miR-34a expression in renal carcinoma cell and the inhibitory effect and regulating mechanism of miR-34a on the proliferation and invasion in human renal carcinoma ACHN cells.
MethodsThe expressions of miR-34a in cancer and pericancerous tissues were detected by real-time polymerase chain reaction(PCR). ACHN cells were transfected with miR-34a mimics and there set blank control group, negative control group and miR-34a mimics group. The expression of miR-34a was measured by real-time PCR 24 h after transfection. The cell proliferation and cell cycle were determined by 5-dimethylthiazol-2-yl-2, 5-diphenyltetrazolium bromide (MTT) and flow cytometry. The invasive ability was examined by Transwell and Matrigel invasive assays. The mRNA and protein levels of YY1 were detected by real-time PCR and Western blot.
ResultsThe relative expression of miR-34a in cancer tissues (1.06±0.67) was significantly lower than that in pericancerous tissues (1.62±0.83, P<0.01). After transfection 24 h, an increase expression of miR-34a was noted in miR-34a mimics group (157.04±13.01) comparing with negative control group( P<0.01). Overexpression of miR-34a significantly inhibited the cell proliferation( P<0.01). The cell cycle was arrested at G0/G1 phases.Transwell and Matrigel invasive assays showed that the invasive ability of cells was significantly suppressed after transfection( P<0.01). YY1 gene had no mRNA expressions after transfection ( P>0.05).
ConclusionsThe expression of miR-34a is low in renal carcinoma,and it may be correlated with tumorigenesis, partially through regulating YY1.
肾癌占成人恶性肿瘤的2%~3%, 其中以肾透明细胞癌最多见[1]。由于肾透明细胞癌对化疗、放疗均不敏感, 免疫治疗也难以取得理想效果, 基因治疗已成为研究的热点。
microRNA是一种长约22个核苷酸的小分子RNA, 广泛存在于真核生物中, 是一组不编码蛋白质的短序列RNA。自2002年Calin等[2]首次报道microRNA异常与肿瘤相关后, 越来越多的研究显示microRNA参于肿瘤细胞发育、分化、凋亡和增殖等的调控, 在肿瘤发生和发展中起重要作用。miR-34a是一个进化保守的microRNA家族miR-34中的一员, 编码基因位于染色体1p36。有文献报道称miR-34a在人类胰腺癌、结肠癌、神经母细胞瘤等众多恶性肿瘤中表达下调或缺失[3, 4, 5], 并认为其低表达促进肿瘤的发生。本研究观察miR-34a在肾透明细胞癌组织中的表达情况, 并使用miR-34a模拟物(miR-34a mimics)转染肾癌细胞株ACHN, 观察miR-34a对细胞增殖、侵袭能力的影响。由于通过软件预测得知转录因子YY1是miR-34a的靶基因, 本研究进一步分析了其对YY1的调控机制。
人肾癌细胞株ACHN(ATCC号:CRL-1611TM)由上海市第十人民医院泌尿外科惠赠; DMEM培养液和胎牛血清购自Hyclone公司和Gibco公司; 逆转录和实时聚合酶链反应(PCR)试剂盒购自TAKARA公司; LiPofectamine2000脂质体转染试剂和 Trizol购自美国 Invitrogen公司; 兔抗人YY1单克隆抗体购自Epitomics公司; 人miR-34a mimics、microRNA 阴性对照( miR Negative Control)由广州锐博生物公司合成; 实时 PCR引物由上海生物工程有限公司合成, 采用茎环法设计miR-34a和内参U6 RNA的逆转录和PCR的引物; 普通基因PCR以18S作为内源性参照, 见表1; Transwell小室购自BD 公司; Matrigel 购自Sigma公司。
| 表1 PCR引物序列、产物长度 |
标本取自上海市第十人民医院2008至2010年间手术切除的20例肾透明细胞癌及对应的癌旁组织, 所有标本于液氮冻存。Trizol裂解组织标本, 抽提总RNA, 逆转录获得各标本cDNA。取2 μ L cDNA为模板, 加入18 μ L PCR反应液[4 μ mol/L基因引物1 μ L, 2× 高灵敏DNA荧光染料(SYBR)Premix Ex Taq 10 μ L, 红色荧光染料ROX Dye(阳性参比信号, 50× )0.4 μ L, 双蒸水(ddH2O)6.6 μ L]。在ABI 7900实时荧光定量PCR仪上进行扩增, 反应条件为:95 ℃ 预变性1 min, 95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 45 s, 共40个循环, 72 ℃ 5 min。
ACHN细胞贴壁生长于DMEM培养液, 置于37 ℃、5% CO2、100%饱和湿度的培养箱中。转染前1 天将细胞以2× 105个/孔接种于6孔板中, 于24 h内当细胞融合达40%~60%时进行转染。采用阳离子脂质体 LiPofectamine 2000按试剂盒操作说明进行转染, 试验分3组:空白对照组(只加脂质体)、阴性对照组、miR-34a mimics 转染组。
Trizol 提取各试验组转染24 h后细胞总RNA, 逆转录获得各标本cDNA。荧光定量PCR, 以U6作为内参, 反应条件同上。
转染5 h后消化细胞以1 000个/孔的密度接种于96孔板上, 每孔补足200 μ L培养基。各试验组每组设5个复孔。转染1、2、3和4 d后每孔加入20 μ L噻唑蓝(MTT), 孵育4 h, 吸弃原液加入150 μ L二甲基亚砜(DMSO)震荡10 min, 酶标仪检测490 nm波长处的吸光度(A)值, 各组求均值做生长曲线。
取至少105个转染24 h后的各组细胞, 离心弃去上清, 用磷酸盐缓冲液(PBS)洗涤2次后, 1× Binding buffer重悬细胞, 加入碘化丙锭(PI)5 μ L, 去RNA酶1.25 μ L, 裂解液(NP40) 0.25 μ L后检测细胞周期。
1. Transwell迁移试验 转染5 h后消化细胞, 以含0.1%牛血清白蛋白(BSA)的DMEM培养液重悬细胞, 5× 104个/小室接种于Transwell上室中, 补足培养基至100 μ L, 下室为500 μ L完全培养基, 20 h后取出将上室内面擦净, 乙醇固定, 结晶紫染色, 清洗, 拍照。33%冰醋酸溶解细胞, 酶标仪检测A573 nm值。
2. Matrigel侵袭试验 50 μ L Matrigel包被Transwell小室, 37 ℃ 1 h。转染5 h后消化细胞, 以含0.1% BSA的DMEM培养液重悬细胞, 1× 105个/小室接种于上室中, 最终保持上室内100 μ L培养基, 24 h后, 按Transwell试验进行后续操作。
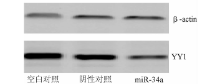
Trizol 提取各试验组转染48 h后细胞总RNA, 逆转录获得各标本cDNA后进行PCR扩增。以18S为内参, 反应条件同上。转染48 h后, 抽提总蛋白, 进行蛋白定量、电泳、转膜、封闭。加入兔抗人YY1抗体(1∶ 1 000)4 ℃孵育过夜, 再加入IRye700× 标记的羊抗兔和IRye800× 标记的羊抗鼠IgG抗体(1∶ 1 000)孵育后, 以β -actin为内参, 用ODYSSEY数字显像系统采集信号。
应用SPSS 17.0软件包对试验数据进行统计, 试验结果以
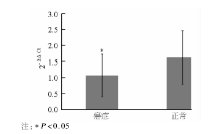
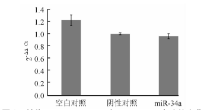
经实时PCR扩增得到各目的基因的Ct值, 以2-△ △ Ct相对定量的方法计算miR-34a与U6拷贝数的比值, 数据经对数转换后比较癌旁组和肾癌组之间的差异, 20例肾癌组织标本中miR-34a的表达量为1.06± 0.67, 明显低于癌旁组织(1.62± 0.83), 差异有统计学意义(t=6.87, P< 0.01)。见图1。
经实时PCR扩增得到各目的基因的Ct值, 以2-△ △ Ct相对定量的方法计算miR-34a与U6拷贝数的比值, 比较试验组和对照组之间的差异, 以
阴性对照组miR-34a表达量为1, miR-34a micmics转染组表达量为157.04± 13.01, 2组差异有统计学意义(t=20.768, P< 0.01); 而空白对照组为1.10± 0.17, 与阴性对照组间差异无统计学意义(t=1.01, P> 0.05)。
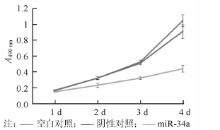
细胞增殖曲线显示, miR-34a mimics转染组细胞增殖速度明显降低, 转染后1、2、3、4 d细胞生长抑制率[(1-AmiR-34a/A阴性对照)× 100%]分别为9%、25%、37%和50%, 以转染后4 d最高, 与阴性对照组比较差异有统计学意义(t=40.53, P< 0.01), 而阴性对照组与空白对照组比较差异无统计学意义(t=0.76, P> 0.05)。见图2。
转染miR-34a mimics后, 处于G0/G1期细胞数百分比增多, 阴性对照组为31.82± 0.97, 与miR-34a组(42.87± 0.40)相比差异有统计学意义(t=18.19, P< 0.01), 空白对照组为33.94± 1.62, 与阴性对照组组间差异无统计学意义(t=1.95, P> 0.05)。见图3。
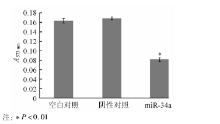
转染miR-34a mimics后, miR-34a组(0.08± 0.004)的细胞穿过小室膜的细胞数较阴性对照组(0.168± 0.003)减少, 差异有统计学意义(t=26.2, P< 0.01)。空白对照组(0.63± 0.005)与阴性对照组比较则差异无统计学意义(t=1.31, P> 0.05)。见图4、5。
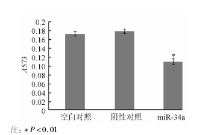
转染miR-34a mimics后, miR-34a组(0.11± 0.007)穿过Matrigel基质胶的细胞数较阴性对照组(0.18± 0.005)明显减少, 差异有统计学意义(t=12.45, P< 0.01), 空白对照组(0.17± 0.005)与阴性对照组则差异无统计学意义(t=1.04, P> 0.05)。见图6、7。
经实时PCR扩增得到各目的基因的Ct值, 以2-△ △ Ct相对定量的方法计算各基因与18 S拷贝数的比值, 比较试验组和对照组之间的差异。结果显示转染48 h后, YY1 mRNA水平无明显变化, 空白对照组为1.22± 0.089, 与阴性对照组(1.0± 0.015)相比差异无统计学意义(t=3.18, P> 0.05)。阴性对照组与miR-34a组(0.96± 0.043)相比差异也无统计学意义(t=0.98, P> 0.05)。Western blot结果显示, 转染48 h后, YY1蛋白表达水平明显降低。见图8、9。
肾癌是泌尿外科常见的恶性肿瘤, 其治疗以外科手术切除为主, 但这给晚期肾癌的治疗带来一定的困难[1] 。近年来对基因治疗的应用研究逐渐成为肾癌新疗法的研究热点。目前已有多种基因治疗方案在临床上得到初步应用, 同时研究人员仍在不断找寻新的治疗基因。而microRNA的发现无疑为肿瘤基因治疗注入了新的活力。
microRNA通过抑制其靶基因, 在肿瘤的发生发展、增殖、凋亡、耐药以及转移等方面均发挥着重要作用, 有可能成为肿瘤治疗的新靶点。50%以上的microRNA编码基因位于与癌症有关的基因区或脆性位点内。在多种类型肿瘤细胞系和肿瘤中均可以检测到microRNA的异常表达。miR-34a的CPG岛甲基化沉默在前列腺癌、乳腺癌、肺癌、结肠癌、膀胱癌、胰腺癌等多种细胞系中存在[6], 这表明miR-34a的失活可能与多种肿瘤的发生、发展相关, 提示其在上述肿瘤中发挥作用。目前对于miR-34a在肾癌细胞中的功能鲜有报道。因此, 研究miR-34a在肾癌中的功能并进一步探索其作用机制有重要意义。
miR-34a在肾癌中的表达如何?是否也参与肾癌的发生和发展?本试验结果显示, 与癌旁组织相比, miR-34a在肾癌中呈低表达, 表明miR-34a的低表达可能在肾癌发生和发展中起一定作用。最新研究证明在胶质瘤细胞U251中miR-34a充当着重要的抑癌基因的角色[7]。在肾癌中miR-34a是否也有着同样重要的作用, 本研究通过直接瞬时转染microRNA mimics对miR-34a功能进行了检测, 该法的优点在于化学合成microRNA简单、快捷, 可避免构建表达载体的步骤, 从而有效提高了特定microRNA的表达。本研究将miR-34a mimics转染入ACHN细胞内, 使miR-34a在肾癌细胞中表达上调, 并发现转染后细胞增殖明显受抑, 这种抑制效应在转染后1~2 d显现, 并持续4 d以上, 且细胞被阻滞于G0/G1期, 有丝分裂受到抑制, 说明miR-34a在促进细胞生长分化方面可能起重要作用。本研究结果还显示, miR-34a mimics 转染组中细胞侵袭迁移能力明显减弱, 提示miR-34a mimics抑制细胞侵袭能力。
我们通过mirBase、TargetScan和PicTar等生物信息学网站分析miR-34a可能的靶基因, 且Chen等[8]已通过荧光素酶报告系统证实YY1是miR-34a的直接靶基因, miR-34a直接与YY1的3'非编码区结合来调控其翻译。YY1具有促进肿瘤细胞增殖、分化和转移的作用, 在前列腺癌、膀胱癌、宫颈癌、骨肉瘤等肿瘤中都显著高表达, 揭示了YY1在肿瘤发展中的重要作用[9, 10]。其在肾癌中的功能目前未见报道, 本课题组前期工作证实了YY1在肾癌细胞中扮演癌基因的作用。利用Western blot技术, 本研究检测出转染miR-34a mimics后ACHN细胞YY1蛋白表达量明显降低, 而mRNA水平无明显变化, 提示在肾癌细胞中miR-34a是在转录后水平对YY1进行调控, 进而起到抑癌的作用。
综上所述, 本试验初步观察到miR-34a的低表达可能是肾癌发生中的重要事件, 在肾癌发生和发展过程中可能具有重要作用, 并初步显示了miR-34a的抑癌作用有可能部分地通过调控YY1来实现。miR-34a有望成为肾癌的诊断和进展的分子标志物, 也可能是肾癌基因治疗的一个有效靶点。然而, 包括YY1在内的这些靶基因及具体、精确的作用机制还有待于进一步的研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|