作者简介:蒯守刚,男,1975年生,硕士,主管技师,主要从事临床微生物检验和耐药机制研究。
研究对氨基糖苷类抗菌药物耐药的鲍曼不动杆菌分子流行病学特征和耐药机制。
方法采用琼脂稀释法检测抗菌药物对鲍曼不动杆菌的最低抑菌浓度(MIC),采用肠杆菌科基因间重复一致性序列(ERIC)-聚合酶链反应(PCR)研究耐药菌株的分子流行病学特征,采用特异性PCR、序列分析和接合试验研究介导耐药的分子机制。
结果临床分离菌株对包括氨基糖苷类抗菌药物在内的多种药物广泛耐药,同源性分析显示属于7个流行克隆型。所有分离菌株均扩增出介导氨基糖苷类抗菌药物耐药的修饰酶和药物“外排泵”基因,部分菌株扩增出甲基化酶基因。
结论修饰酶和甲基化酶介导鲍曼不动杆菌临床分离株对氨基糖苷类药物耐药,药物“外排泵”参与介导耐药机制形成,垂直传播和通过耐药性质粒的水平传递可能是耐药菌株播散的主要方式。
To investigate the molecular epidemiology and mechanism of aminoglycoside resistance to Acinetobacter baumannii isolates.
MethodsAgar-dilution was carried out to detect the minimum inhibitory concentration (MIC), and enterobacterial repetitive intergenic consensus(ERIC)-polymerase chain reaction(PCR) was performed to analyze the molecular epidemiology of aminoglycoside-resistance isolates. Specific PCR,DNA sequencing,conjugation experiments were carried to confirm the transmission mechanism.
ResultsAll the clinical isolates were resistant to most drugs including aminoglycosides, and ERIC-PCR showed the isolates belonged to 7 genotypes. Specific PCR and DNA sequencing revealed that all isolates encoded aminoglycoside-modifying enzyme genes, efflux pump gene and methylase gene.
ConclusionsProducing of aminoglycoside-modifying enzyme and methylase mainly contribute to reduce the susceptibility of aminoglycosides in Acinetobacter baumannii. Efflux pump overexpression may as a cofactor in high-level aminoglycoside resistance. Vertical transmission and plasmid-mediated horizontal transmission are probably the principal epidemical mechanisms.
不动杆菌是目前引起院内感染的重要病原菌, 其广泛存在于自然界和人体表面, 在机体免疫力受损时可引起各种感染, 包括肺炎、菌血症、尿路感染和导管相关性感染等。随着包括氨基糖苷类药物在内的多种抗菌药物在临床的广泛应用, 泛耐药型菌株的临床分离率不断上升, 给临床治疗带来极大困扰。我们对临床收集的34株鲍曼不动杆菌介导氨基糖苷类药物耐药的基因型及相关耐药机制进行探讨, 旨在为临床治疗提供参考。
34株氨基糖苷类药物耐药的鲍曼不动杆菌为无锡市第五人民医院微生物实验室2009至2010年收集的不重复菌株, 其中痰液28株、血液2株、尿液2株、胆汁1株、伤口分泌物1株。分离菌株均采用VITEK-32进行鉴定和药物敏感性检测。接合试验受体菌为对利福平耐药的大肠埃希菌600, 由浙江大学附属邵逸夫医院俞云松教授惠赠。质控菌株为大肠埃希菌(ATCC 25922)和铜绿假单胞菌(ATCC 27853), 由本室保存。
聚合酶链反应(PCR)扩增仪(Eppendorf 公司, 德国); BIO-RAD凝胶成像分析系统(BIO-RAD公司, 美国); Taq DNA聚合酶、dNTPS(TaKaRa公司, 日本); 水解酪蛋白胨(MH)和LB培养基(Oxoid公司, 英国)。
VITEK-32 GNS-448卡检测为氨基糖苷类耐药的鲍曼不动杆菌, 用纸片扩散法(K-B法)重复检测耐药后采用琼脂稀释法检测抗菌药物对耐药菌株的最低抑菌浓度(MIC), 具体参照美国临床实验室标准化协会(CLSI)推荐的方法执行[1]。
采用肠杆菌科基因间重复一致性序列(ERIC)-PCR对临床收集的鲍曼不动杆菌进行染色体基因组同源性分析, 引物设计参考文献[2]。PCR扩增条件为:95 ℃预变性7 min, 95 ℃变性30 s, 50 ℃退火1 min, 65 ℃延伸8 min, 30个循环, 65 ℃延伸16 min。用BIO-RAD凝胶成像分析系统进行成像分析。
采用PCR扩增修饰酶、甲基化酶、碳青霉烯酶和药物“ 外排泵” 基因。煮沸法提取细菌DNA, 引物及扩增条件见表1, 部分菌株扩增产物送上海英骏公司测序, 测序结果在GenBank网上查询分析。
| 表1 本研究所采用的PCR引物 |
在进行氨基糖苷类药物的MIC测定时, 在平板中另外加入5 mg/L的CCCP(该浓度对外排泵有较好的抑制作用, 而对细菌生长无抑制作用), 以测定CCCP对氨基糖苷类药物在体外对鲍曼不动杆菌抗菌活性的影响。结果判读:当CCCP应用后氨基糖苷类药物的MIC下降是应用前的1/4或更低时说明有主动外排机制存在。
受体菌为利福平耐药的大肠埃希菌600。挑取供体菌和受体菌单个菌落接种于2 mL LB肉汤, 37 ℃摇床培养4 h。各吸取供体菌和受体菌菌液0.5 mL置于1.5 mL U型管中混匀。37 ℃静置培养4 h。吸取混合菌液100 μ L均匀涂布于含抗菌药物的MH平板(本试验采用含64 mg/L阿米卡星和256 mg/L利福平)。37 ℃静置培养14 h后挑取单个克隆再次移种含复合抗菌药物的平板过夜培养, 然后制DNA模板用PCR进行阳性接合子的验证。
34株临床分离株的药物敏感性试验结果显示, 鲍曼不动杆菌对左氧氟沙星、环丙沙星、复方磺胺甲口恶唑敏感率分别为80%、85%和37%, 对头孢他啶、头孢吡肟、哌拉西林-他唑巴坦和头孢哌酮-舒巴坦的敏感率分别为23%、30%、29%和41%, 见表2。
| 表2 34株分离株与部分接合子药物敏感性试验结果 |
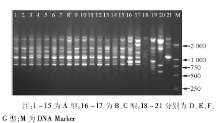
根据ERIC-PCR电泳条带数量和位置进行判断, 条带位置和数量完全相同者为相同克隆型, 相差1条者为密切相关, 其余为不同克隆株。本研究中34株鲍曼不动杆菌属于7个流行克隆型, 其中A克隆型24株, B克隆型3株, C和D克隆型分别有2株, E、F和G克隆型分别各有1株。见图1。
34株鲍曼不动杆菌中, 介导氨基糖苷类药物耐药的aac(3)、 aac(6)、armA基因以及药物外排泵基因adeB和介导碳青霉烯类药物耐药的blaOXA-23基因的检出情况以及各耐药基因组合情况见表3。
| 表3 34株鲍曼不动杆菌耐药基因型检测结果 |
分别测定在加入CCCP前后庆大霉素和阿米卡星2种药物对鲍曼不动杆菌的MIC, 阿米卡星在加入CCCP后MIC比加入前下降了4~32倍, 而庆大霉素下降了2~8倍, 同等条件下阿米卡星MIC下降水平较庆大霉素明显。
所有34株鲍曼不动杆菌中有21株的质粒接合试验为阳性, 表明鲍曼不动杆菌的氨基糖苷类耐药基因可以通过质粒接合方式将耐药性进行转移, 氨基糖苷类抗菌药物对接合子与相应供体菌的MIC结果比较, 相应接合子下降2~4个稀释倍数不等。
不动杆菌广泛存在于水和土壤中, 是院内感染的重要病原菌之一, 耐药菌株的广泛播散尤其是泛耐药菌株的出现, 表明不动杆菌具有对选择性环境压力快速适应的能力[4], 这种适应性改变主要通过2种方式得以实现, 即内源性耐药机制的上调和外源性耐药基因的捕获[5]。本研究对34株临床分离的氨基糖苷类药物耐药鲍曼不动杆菌的药物敏感性试验结果分析显示, 分离菌株对环丙沙星和左氧氟沙星保持较高的敏感性(80%以上), 这可能和专科患者的类型不同而药物选择类型不同有关。通过ERIC-PCR对菌株进行同源性分析显示, 70%(24/34)的菌株均为A型克隆株, 提示此期间存在A型克隆株在住院患者之间传播。另外在研究中发现部分同克隆型菌株具有不同的耐药基因型和表型, 分析其原因可能与该流行克隆株在不同感染个体所接受的抗菌药物压力不同, 使其产生适应性抗药机制, 从而发生基因型和表型改变有关。
氨基糖苷类抗菌药物作为临床治疗革兰阴性杆菌感染中广泛应用并且最有效的药物之一, 具有广谱、高效以及浓度依赖性的快速杀菌特点, 与细胞壁活性抗菌药物联合使用产生协同作用。细菌对氨基糖苷类药物耐药的主要机制是产生氨基糖苷类修饰酶以及近年报道逐渐增多的16S rRNA甲基化酶[6, 7, 8], 另外药物“ 外排泵” 参与也可介导氨基糖苷类药物耐药。本研究中34株鲍曼不动杆菌均检出aac(3)、 aac(6) 或armA基因, 且多数菌株为多种基因阳性, 表明无锡市第五人民医院流行的氨基糖苷类药物耐药的鲍曼不动杆菌主要由氨基糖苷类酶基因介导, 这些酶基因可能定位于染色体上, 也可通过质粒交换获得, 通过质粒接合试验显示本研究中62%(21/34)菌株的耐药性基因可通过接合性质粒将耐药性传递, 给临床抗感染的治疗带来新的挑战。接合子和供体菌比较, 氨基糖苷类药物的MIC有所下降, 通过基因型和外排泵表型抑制试验证实与AdeB药物外排泵的激活有关。另外可能质粒在受体菌和供体菌的表达差异以及细菌存在外膜通道蛋白缺失引起药物内流下降也参与其中。所检测的16S rRNA甲基化酶基因阳性的菌株除了对庆大霉素和阿米卡星高度耐药外, 对其他多种抗菌药物耐药, 呈多重耐药, 这主要原因可能是16S rRNA 甲基化酶基因常和超广谱β -内酰胺酶(ESBLs)等基因共存于同一菌体甚至同一质粒上[9]。
所有鲍曼不动杆菌均扩增出药物外排泵基因adeB, AdeB是跨膜质子梯度能驱动类外排系统的RND超家族成员[10, 11]。其与AdeA、AdeC共同形成一个三聚体外排结构, 参与对氨基糖苷类与碳青霉烯类等多种药物的外排[12, 13, 14, 15]。CCCP为能量抑制剂, 可通过抑制主动外排系统能量来源的质子浓度梯度, 影响细菌药物外排系统的主动外排作用。本研究中通过CCCP逆转试验表明, 菌株中普遍存在依赖质子泵的外排蛋白参与药物外排。另外在同等试验条件下阿米卡星的MIC水平下降较庆大霉素明显, 可能由于阿米卡星和庆大霉素的亲水性不同, 而CCCP显著破坏了亲水性更强的阿米卡星的跨膜质子浓度梯度, 明显抑制依赖质子驱动供能的主动外排系统, 从而明显减低其MIC。因此, 加强临床耐药机制研究, 对于临床合理用药和控制耐药菌株的播散有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|