作者简介:黄妩姣,女,1978年生,硕士,副主任技师,主要从事临床免疫学检验与研究工作。
通讯作者:黄宪章,联系电话:020-81887233-32908
对A和B 2种定性检测人血清抗乙型肝炎病毒e抗体(HBeAb)的酶联免疫吸附试验(ELISA)试剂盒进行评估,为实验室选择合适的HBeAb试剂提供实验依据。
方法参照美国临床实验室标准化协会(CLSI)EP12-A2文件推荐方法,对A和B 2种HBeAb检测试剂做偏倚和不精密度分析,比较2种HBeAb检测试剂的C50、C5~C95区间以及不精密度曲线。用2种试剂同时检测910份标本的HBeAb,计算检测结果一致程度的95%可信区间( CI),计算( Kappa)值,评价一致性。
结果A试剂检测血清HBeAb的C50小于B试剂的C50,A试剂的C5~C95区间比B试剂的窄,A试剂的不精密度曲线比B试剂的陡峭;2种试剂检测标本HBeAb一致程度的95% CI为93.2%~96.1%, Kappa值约0.87。
结论EP12-A2作为定性检测的性能评价方法可行。
To evaluate A and B ELISA kits for detecting qualitatively anti-hepatitis B e antigen antibody(HBeAb),and to provide useful reference for choosing suitable HBeAb kits.
MethodsAccording to Clinical and Laboratory Standards Institute (CLSI) EP12-A2 document,the bias and imprecision of A and B HBeAb kits were analyzed,and their C50,C5-C95 intervals and imprecision curves were compared.The HBeAb of 910 specimens were simultaneously determined by both A and B kits.The 95% confidence interval ( CI)for concordance was calculated.The Kappa value was calculated to evaluate their concordance.
ResultsC50 for A kit was less than that for B kit.C5-C95 interval of A kit was narrower than that of B kit.The imprecision curve of A kit was steeper than that of B kit.The 95% CI for concordance was calculated as 93.2%-96.1%,and the Kappa value was 0.87.
ConclusionsEP12-A2 is a useful protocol for the evaluation of qualitative test performance.
定性试验在临床应用广泛, 可用于疾病的筛查、诊断或监测。由于人们在定性试验的试验设计、数据分析以及结果解释方面强调的重点不同, 定性试验的性能评价规则也多样, 目前还未形成一个统一的方法。美国临床实验室标准化协会(CLSI)EP12-A2文件《定性检测性能评价的用户协议》[1]为定性试验性能评价的实验设计以及数据分析提供了一个规范的、概括性的研究方法。文件要求定性检测的性能评价也应该像定量试验[2, 3]一样, 将偏倚(系统误差)和不精密度(随机误差)考虑进来, 通过性能评价来熟悉和了解影响该方法近临界值精密度的潜在变异来源, 并在必要时建立合适的实验条件。
目前我国对乙型肝炎病素e抗体(HBeAb)定性检测试剂盒的评价标准主要有:(1)阴性符合率:15份参比品符合率(-/-)应为15/15; (2)阳性符合率:10份参比品符合率(+/+)应≥ 9/10; (3)最低检出限:应符合3份系列稀释参比品的检出要求; (4)精密度(CV):平行测定10孔, (CV)≤ 20%; (5)质控血清:结果为阳性。这些性能评价指标没有对标本的具体浓度提出要求。事实上, 用浓度接近临界值的标本作为评价材料, 比用强阳性或低阴性标本更能发现检测误差。CLSI EP12-A2文件推荐方法弥补了上述不足。我们参照EP12-A2文件对A、B 2种定性检测HBeAb的酶联免疫吸附试验(ELISA)试剂进行性能评价。
罗氏Cobas 411电化学发光分析仪及原装配套试剂、质控物、校准品。罗氏HBeAb检测试剂批号:155934-02; 质控品批号:15494599; 校准品批号:15593402。TECAN Genesis RSP150/8+BEPIII全自动酶免分析仪。HBeAb定性检测试剂盒:A试剂盒批号为20100301、B试剂盒批号为201006011。HBeAb室内质控品购自卫生部临床检验中心, 浓度为4 NCU/mL, 批号为200907002。0.9%生理盐水等。
HBeAb强阳性标本1 ∶ 380稀释时, 用A试剂重复检测, 阳性结果为16/40(40%); HBeAb强阳性标本1 ∶ 240稀释时, 用B试剂重复检测, 阳性结果为23/40(57.5%); 2个阳性结果百分数均在35%~65%之间。见表1、2。
| 表1 A试剂定性检测HBeAb的C50估计 |
| 表2 B试剂定性检测HBeAb的C50估计 |
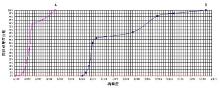
A试剂的不精密度曲线陡峭, B试剂的不精密度曲线相对平滑, A试剂检测HBeAb的C5~C95区间比B试剂的C5~C95区间窄。见图1。
乙肝标志物中HBeAg转阴, 并产生HBeAb是判断病情趋向和药物疗效的一个重要指标[5], 正确检出HBeAb对临床医生判断病情起着重要作用。本实验室之前一直使用B试剂(ELISA)定性检测血清HBeAb。在日常工作中发现弱阳性室内质控得不到预期(+)结果; 曾经在某次卫生部室间质评中, HBeAb预期结果为(+), 而B试剂检测结果为(-)。为给临床提供准确的诊断依据, 本实验室打算更换新的HBeAb试剂。根据ISO15189:2007《医学实验室— 质量和能力的专用要求》, 实验室更换或使用新的检测试剂或系统, 需对之进行性能验证。2008年出版的EP12-A的修订版EP12-A2, 新增了关于CI的内容, 让用户能在观测数变少或更多的时候, 直接鉴别CI的差异。另外, 还包含和定义了一些新的术语如“ C5~C95区间” 等。本研究直接利用EP12-A2文件对HBeAb新旧试剂进行性能评价和比较。
从表1结果看出, A试剂的C50(1.08 COI)小于B试剂的C50(0.757 COI), 说明A试剂的敏感性高于B试剂, A试剂的C50更接近临界点, 偏倚更小。由此也证实了之前本实验室使用B试剂检测HBeAb, 室内质控和室间质评均得不到预期(+)结果的主要原因是B试剂敏感性较低所致。
描述不精密度的方式有多种, EP12-A2文件用C5和C95描述实验室某定性方法的不精密度。不同方法检测相同标本, 其C5~C95区间, 或结果能达到一致要求的浓度范围可能不同, 能鉴别这种差异的能力对定性实验评价是一有用工具。C5~C95区间的宽度暗示了定性试验的精密度, 因为其反映了重复性检测结果不一致的浓度范围。C5~C95区间越窄, 代表方法越好。图1通过对A、B试剂定性检测HBeAb的不精密度曲线及C5~C95区间比较, 都反映了一个事实:A试剂在接近C50处的精密度优于B试剂, 用 A试剂对浓度接近临界值的HBeAb进行重复检测, 得到结果的一致程度比B试剂好。
在采用一种新的检测方法检测患者标本之前, 实验室操作人员必须评价该检测方法在临床实验室中的检测能力; 或当实验室同时使用2套以上检测系统检测同一项目时, 必须保证两者结果的一致性。这在《医学实验室质量和能力认可准则在临床免疫学检验领域的指南》里都作了明确的规定[6]。真正定性检测的性能指标是灵敏度和特异性。当诊断明确时, 计算灵敏度和特异性很容易, 但临床检验过程中很多检测的诊断都不明确, 在不清楚疾病患病率的情况下, 只能计算2种方法在多大程度上一致。本研究用A、B试剂进行了10 d的试验, 共检测了910份临床标本的HBeAb, 最大限度地获得了具有代表性的标本以及在日常实验室使用条件下来评价候选试剂。虽然比对标本是随机选择的, 而实际上每天的标本中, 真实阳性率是变化的。比对标本中阳性标本的比例极大地影响着该区间的计算结果以及Kappa值, 特别是随着接近临界值浓度的标本增多, 出现不一致的可能性愈大。因此, 每次选择的标本浓度不同, 用该方法计算得到的区间也将不一样。但本研究结果提示2种试剂对临床标本的检测结果一致性良好。在A试剂更精密、更高敏感的前提下, 可替换B试剂供临床使用。
本研究利用CLSI EP12-A2文件对HBeAb定性检测做性能评价, 不仅为本实验室选择A试剂进行HBeAb检测提供了实验依据, 也为其他定性检测的性能验证提供了规范、概括性的实验设计和研究。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|