通讯作者:胡忠义,联系电话:0214-65115006-3037。
作者简介:彭荣,女,1986年生,学士,主要从事微生物和免疫学研究。
提取纯化结核分枝杆菌(MTB)脂阿拉伯甘露聚糖(LAM),建立抗LAM抗体(LAM-IgG)检测的酶联免疫吸附试验(ELISA)。
方法MTB菌体彻底破碎后,去除蛋白、脂质、核酸,得到粗制的脂多糖。经Sephacryl-100凝胶过滤层析分离纯化,得到LAM。以该LAM作为间接ELISA的包被抗原来检测血清中的LAM抗体。
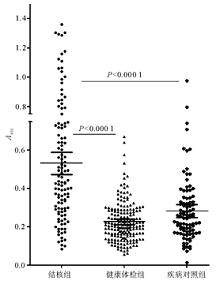
结果所得LAM经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)银染,与对照标准品大小一致,为37 000。115例肺结核患者LAM抗体阳性率71.3%;92例非结核肺部疾病患者假阳性率11.9%;188名健康体检者假阳性率3.2%。敏感性71.3%,特异性93.9%。
结论本研究成功提取到LAM抗原,此抗原可作为间接ELISA的包被抗原用于结核抗体的检测。
To extract and purify lipoarabinomannan(LAM)from
The MTB was crashed. The protein, nucleic acid and lipids were removed, and crude lipopolysaccharides were prepared. The crude lipopolysaccharides were purified by Sephacryl-100 gel filtration, and LAM was obtained. The LAM was used as coating antigen to detect LAM-IgG by indirect ELISA.
ResultsThe relative molecular weight of the prepared LAM was determined by silver staining of sodium dodecyl sulfate polyacrylamide gel electrophoresis (SOS-PAGE). The result was approximately 37 000, consistent with the reference material. The positive rate of LAM-IgG was 71.3% in 115 pulmonary tuberculosis patients. The false positive rates were 11.9% in 92 other non-tuberculosis lung disease patients and 3.2% in 189 healthy subjects. The sensitivity and the specificity were 71.3% and 93.9%.
ConclusionsLAM antigen is prepared successfully and can be used as coating antigen in indirect ELISA to detect anti-MTB antibody.
我国是结核病的高感染、高发病率国家,结核病的患者数在世界各国中居于第2位。寻找快速、准确、及时诊断结核病的新方法是控制结核病的重要手段。血清学检查因其取样方便、操作简便、快速、不依赖病原菌的检查,是临床上诊断结核病的重要辅助手段。但特异性免疫诊断依赖于特异性抗原。近十几年来人们关注到一类菌壁糖脂抗原—脂阿拉伯甘露聚糖(lipoarabinomanan, LAM)。LAM是细胞壁的主要成分,在结核分枝杆菌(MTB)与宿主的相互作用中起着关键作用并深刻影响细胞、体液免疫的发生与发展。但国内一直未见LAM提取纯化的相关报道,本研究参照国外有关文献[ 1],并略作改进,从MTB中提取了LAM,初步建立了LAM的提取纯化方法,并将其作为包被抗原检测结核患者血清抗体,取得了较为满意的结果。
1.菌种 MTB标准菌株H37Rv为上海市肺科医院菌株库保存菌株。
2.培养基 改良罗氏培养基由上海市肺科医院检验科提供。
3.主要试剂和仪器 DNase I 酶、RNase酶为Sigma公司提供,氯仿、甲醇、苯酚、硫酸、乙醇均为国产分析纯。细胞粉碎机为宁波新芝超声设备有限公司产品。AKTA design系统、Sephacryl-100凝胶过滤层析柱为GE公司产品。
4.血清标本 全部来自上海市肺科医院2010年1月至6月住院患者和健康体检者,其中结核患者115例,男62例,女53例,年龄1172岁,平均(39±6)岁;非结核肺部疾病患者92例,男56例,女36例,年龄3373岁,平均(48±5)岁;健康体检者188名,男102名,女86名,年龄2034岁,平均(25±3)岁。
5. ELISA试剂 酶标板为科华生物公司96孔板,酶标抗体为辣根过氧化物酶标记的羊抗人IgG,为Sigma公司产品,底物为华美公司的四甲基联苯胺(TMB)。包被抗原的缓冲液为0.05 mol/L、pH值9.6碳酸盐缓冲液;封闭液为0.01 mol/L、pH值7.4磷酸盐缓冲液(PBS),内含3%脱脂奶粉;标本稀释液为0.01 mol/L、pH值7.4的PBS,洗涤液为0.05%Tween-20的PBS,终止液为1 mol/L的H2SO4。
1.LAM抗原的提纯 将MTB H37RV接种在罗氏鸡蛋培养基上,37 ℃培养34周,收取菌落,100 ℃ 2 h灭活细菌,用蒸馏水和PBS(pH值7.4)各洗涤1次,再用氯仿∶甲醇=2∶1混合液脱脂3次,去除菌体中的培养基成分。研磨菌体,用PBS(pH值7.4)悬浮,冰浴超声破碎(5 s,10 s,30 min),超声破碎后的溶液加入等体积的无水乙醇,在95 ℃水浴锅中回流1 h,离心取上清,对PBS(pH值7.4,1 mmol/L MgCl2)透析3 d,聚乙二醇20000(PEG20000)浓缩,沉淀抗酸染色镜检未见完整菌体。加入DNase I酶、RNase酶,37 ℃过夜。所得溶液加入等体积88%的苯酚溶液,70 ℃振荡60 min后,4 ℃ 4 300 r/min离心(离心半径20 m)30 min取水层,将酚层加入等体积水再抽提1次。合并水层。流水冲洗2 d,再对蒸馏水透析2 d。PEG20000浓缩为原来体积的1/4。选取Sephacryl S-100凝胶柱层析,连接AKTAdesign系统。用 NaCl(0.05 mmol/L)溶液洗脱,流速0.5 mL/min,2 mL/管收集,每管用苯酚—硫酸法跟踪检测糖含量。
2.LAM的鉴定 浓缩胶5%,分离胶15%,浓缩胶工作电压100 V,分离胶工作电压150 V。标本和LAM对照标准品(克罗拉多州立大学赠送的LAM抗原,浓度1 mg/mL)煮沸3 min,加样量20 μL。电泳后分别用考马斯亮蓝染色和硝酸银染色。考马斯亮蓝染色参照常规方法操作。硝酸银染色[ 2]用高碘酸、乙醇、乙酸混合液氧化过夜,硝酸银氨水溶液避光浸泡10 min,水洗,加入甲醛、柠檬酸还原液开始显色。标本糖含量测定:苯酚—硫酸法测定标本中多糖的含量,取浓硫酸1 mL,9%苯酚200 μL,标本200 μL,以无水蔗糖为多糖标准, 制作浓度范围0.2 ~3.0 mg/mL的标准曲线,测吸光度( A)485值,直线回归计算标本中多糖含量;标本和标准品蛋白含量的测定:Bradford法测定标本和标准品中蛋白的含量,取标本和标准品各20 μL,加入考马斯亮蓝G250试剂200 μL,以牛血清白蛋白作蛋白标准,制作浓度范围0 ~10 μg/mL的标准曲线,测其 A600值,直线回归计算标本和标准品中蛋白含量。
3.酶联免疫吸附试验(ELISA) 用包被缓冲液将LAM抗原做系列稀释,分别以0.5、1、2、5和10 μg/mL的浓度包被酶标板,经棋盘方阵滴定法选择包被抗原的工作浓度,然后将LAM稀释至最适包被浓度,酶标板每孔加入100 μL,置4 ℃过夜。洗涤3次,在吸水纸上拍干以后每孔加封闭液300 μL,置37 ℃ 2 h,洗涤3次,每孔加入标本稀释液稀释的血清标本100 μL,置37 ℃ 1 h,洗涤3次拍干。每孔加入100 μL工作浓度的酶标抗体(羊抗人IgG-HRP),置37 ℃ 1 h,洗涤3次拍干。每孔加入100 μL TMB底物溶液,置37 ℃ 10 min。最后每孔加入50 μL的终止液,在酶标仪上测定每孔的 A450值。
应用GraphPad Prism 5(GraphPad Software Inc.,San Diego,USA)对数据进行统计学分析。数据符合正态分布,采用 t检验, P<0.05表示差异有统计学意义。
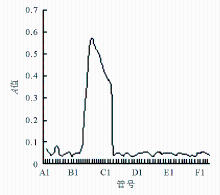
AKTAdesign系统自动收集144管收集液,从A1到L12。苯酚硫酸法检测每管收集液的多糖浓度得出一个糖峰:B6-C2,见 图1,可确定B6-C2对应的收集液中含有LAM糖。将此收集液合并浓缩到5 mL,得到标本。
标本经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),考马斯亮蓝染色未见明显条带,可见蛋白含量很低。硝酸银染色得到一个与标准品大小一致的亮黄色条带,与蛋白Marker染出的黑色条带区别明显,大小约37 000,见 图2。苯酚硫酸法测LAM标本中LAM糖含量为1.2 mg/mL,Bradford法测LAM标本中蛋白含量为18 μg/mL(标准品中蛋白的含量为15 μg/mL),可见标本中LAM糖为主要组分。
经棋盘方阵滴定法确定的ELISA检测LAM-IgG最佳条件为 LAM抗原1∶1 000稀释1 μg/mL包被,血清标本1∶400稀释,酶标抗体为1∶20 000稀释,显色时间10 min。
LAM 是结核感染过程中重要的免疫反应调节因子,是MTB与巨噬细胞和树突状细胞作用的重要配体[ 3]。MTB能在巨噬细胞中存活,很大程度上是依赖于LAM对吞噬溶酶体合成的抑制[ 4]。其次,LAM能抑制γ干扰素(IFN-γ)的转录和削弱巨噬细胞的吞噬杀伤作用[ 5]。因此,LAM作为MTB的重要抗原,一直是结核病发病机制、免疫病理、诊断治疗的研究靶点。国外研究者对LAM-IgG检测用于结核病诊断做过研究[ 6],并开发出相应的诊断试剂盒。国内也有学者购买国外的抗原或试剂盒开展应用评估[ 7, 8],但未见自主提纯制备LAM抗原并用于结核病血清学诊断的报道。
依赖进口试剂,价格较为昂贵,限制了此项诊断技术的应用推广,也限制了一系列以LAM为突破口的针对结核病的研究。本研究旨在摸索LAM抗原的国产化方向,并尽可能简化优化纯化方法,将纯化得到的LAM抗原初步运用于血清学诊断,也为以后以LAM为基础的研究提供充足的材料来源,如对LAM的功能研究、专一抗体制备、抗结核药物的筛选分析、MTB感染的诊断和检测以及预后应用都有很大的意义。
关于LAM的纯化,Hunter等[ 9]曾用离子交换层析和凝胶层析的方法,Leopold等[ 10]也曾用疏水作用色谱的方法,皆比较繁琐。本研究在Hamasur等[ 1]方法的基础上添加了将菌体脱脂和超声后的乙醇回流2个步骤,脱脂能除去培养基的污染,为LAM的纯度奠定基础;乙醇回流能使菌体破碎的更完全,提高提取的效率。回流得到的上清,经DNase I酶、RNase酶除去DNA和RNA, 热酚水法去蛋白,氯仿∶甲醇去酚和脂质,得到粗的脂多糖。再将脂多糖经过Sephacryl-100凝胶过滤层析分离纯化,用苯酚硫酸法跟踪洗脱液的糖浓度,得到一个糖峰,将此糖峰对应的收集液合并浓缩得到标本,总过程用时1周。标本经SDS-PAGE银染确定为LAM,含量为1.2 mg/mL,比对照标准品1 mg/mL高;蛋白含量18 μg/mL,也比对照15 μg/mL略高,浓度和纯度都比较理想。
用此LAM抗原,通过ELISA检测了115例结核病患者、92例非结核肺病患者及188名健康体检者血清的LAM抗体,敏感性为71.3%,特异性为93.9%。值得一提的是,在非结核肺病患者组,11例假阳性中,有5例上海奥普生物公司生产的TB-Dot试剂盒检测结果也为阳性。TB-Dot试剂盒为国内临床大范围使用的结核抗体试剂盒,可靠性比较高,故不能排除这5例有合并结核的可能。Sade等[ 6]检测了31例肺结核患者和117例其他疾病患者及健康对照者血清,敏感性80.6%,特异性91.5%。马玙等[ 8]用ELISA检测90 例肺结核患者血清、53例肺癌患者及30名正常人血清,敏感性82.0%,特异性94.0%,敏感性的差异可能和ELISA的一系列条件有关,如抗原纯度、抗原包被浓度、血清稀释度、酶标抗体效价、显色系统等诸多因素。
有报道检测脑脊液中抗LAM抗体对结核性脑膜炎[ 11]和检测胸水中抗LAM抗体对结核性胸膜炎[ 12]的诊断价值都较高。而且有国外学者探寻用ELISA在尿液中[ 13] 、痰液中[ 14]、脑脊液中[ 15]检测LAM抗原诊断结核病。因此,有关抗LAM抗体和LAM抗原检测的相关研究,我们正在进一步探索之中。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|